
科目: 来源: 题型:
【题目】合成氨工业在工农业生产、生活中有着重要作用。反应原理为:3H2(g)+N2(g)![]() 2NH3(g) △H < 0。
2NH3(g) △H < 0。
(1)在T ℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是__________(填序号)。
a.容器内的压强不再随时间变化
b.3υ(N2)=υ(H2)
c.3υ正(H2)=2υ逆(NH3)
d.混合气体的密度保持不变
②达上述平衡后,其他条件不变,升高温度,υ逆___________________(填“增大”、“不变”、“减小”),υ正和υ逆的关系为υ正___________υ逆(填:“>”、“=”、“<”),最后二者相等。
③该条件下达到平衡时,向容器内充入惰性气体,增大容器内的压强,NH3的体积分数将(填:“变大”、“不变”或“变小”)。________
(2)在T ℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是______。
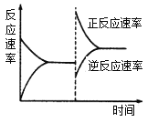
a.升高温度,同时加压b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)在T ℃时,将0.6 mol H2和0.4 mol N2置于容积为2 L的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。
2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。
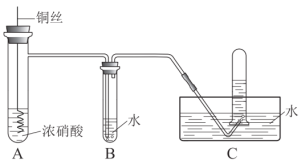
(1)浓硝酸一般盛放在棕色试剂瓶中,原因是______。
(2)Cu与浓硝酸反应的化学方程式是______,其中硝酸体现酸性和______性。
(3)B中反应的化学方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应与电化学和金属的防护密切相关。请回答下列问题:
(1)将反应2Ag++Cu = 2Ag+Cu2+ 反应设计成如图所示的原电池.

则Ag 发生的反应是_______反应(填“氧化”、“还原”),X极的电极反应式为_______,该电池放电时,盐桥中的NO3-离子将移向_________溶液。如果将盐桥换成Cu条,则甲池为__________池(装置),X的电极名称是_________。
(2)铅蓄电池是当今生活中应用比较广泛的一种可充电电池,总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
2PbSO4 +2H2O。放电时,负极反应式为_______________;充电时,铅蓄电池的正极应与直流电源的________极相连,该电极的电极反应式为_____。
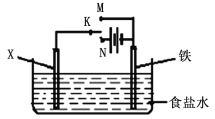
(3)金属的防护方法有多种。如图是模拟铁的电化学防护。若X为碳棒,为减缓腐蚀,开关K应置于________处;反应的总反应离子方程式为______________,若X为锌,开关K置于M处,该电化学防护法称为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关溶液中微粒浓度关系的叙述错误的是
A.![]()
![]() 溶液中:
溶液中:![]()
B.pH相等的①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 四种溶液的物质的量浓度大小:①>②>③>④
四种溶液的物质的量浓度大小:①>②>③>④
C.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合得溶液中:
的氨水等体积混合得溶液中:![]()
D.向![]()
![]() 溶液中滴加NaOH至溶液恰好呈中性:
溶液中滴加NaOH至溶液恰好呈中性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmolˉ1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H++OH-=H2O; △H =-57.3 kJmolˉ1
C.已知 H2 燃烧热为 142.9kJmolˉ1 ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H =-285.8 kJmolˉ1
D.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ;△H=-38.6kJ· mol-1
2NH3(g) ;△H=-38.6kJ· mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
Ⅰ | 25 | 0.1 | 0.1 |
Ⅱ | 25 | 0.2 | 0.1 |
Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。
②为探究浓度对化学反应速率的影响,应选择______和______。
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g),X的物质的量随时间的变化如下表:
2Z(g),X的物质的量随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
X的物质的量/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲可以判断出反应A(g) + B(g)![]() 2C(g) 的△H<0,T2>T1
2C(g) 的△H<0,T2>T1
B. 图乙表示压强对可逆反应2A(g) + 2B(g)![]() 3C(g) + D(s)的影响,乙的压强比甲的压强大
3C(g) + D(s)的影响,乙的压强比甲的压强大
C. 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4
D. 图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入盐酸体积的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,金属离子(Mn+)浓度的负对数值随溶液pH变化关系如图所示[已知:pM=-lgc(Mn+),且假设c(Mn+)≤10-6mol/L认为该金属离子已沉淀完全]。根据判断下列说法正确的是( )
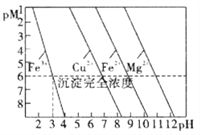
A. 常温下,Ksp[Mg(OH)2]<Ksp[Fe(OH)2]
B. 可以通过调节溶液pH的方法分步沉淀Cu2+和Fe2+
C. 除去Cu2+中少量Fe3+,可控制溶液3≤pH<4
D. pM与Ksp之间的关系式为:pM=lgKsp- nlgc(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
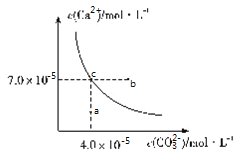
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反应历程:
第一步:2N2O5 ![]() NO2 +NO3 快速平衡;
NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反应;
第三步:NO+ NO3 →2NO2 快反应;其中可近似认为第二步反应不影响第一步平衡。下列表述正确的是
A.υ逆(第一步) < υ正(第二步)B.反应的中间产物只有NO
C.第二步中NO2 和NO3 碰撞部分有效D.第三步正反应的活化能较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com