
科目: 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
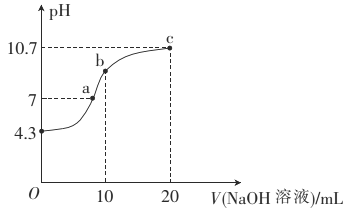
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作、发生的现象、解释或结论都正确的是![]()
选项 | 实验操作 | 发生现象 | 解释或结论 |
A | 向NaCl和KI的混合溶液中,逐滴加入 | 溶液中先产生白色沉淀,后产生黄色沉淀 |
|
B | 用玻璃棒蘸取氯水点到蓝色石蕊试纸上 | 试纸先变红后褪色 | 氯水中含有 |
C | 将铜片与芯片用导线连接后,插入稀硫酸中 | 铜片上有气泡产生 | 在锌的作用下,铜与硫酸反应产生氢气 |
D | 向某溶液中加入过量盐酸 | 产生能使澄清石灰水变浑浊的无色气体 | 该溶液为 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计一个电池(如下图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

(1)通入氢气的电极为________ (填正极或负极),该电极反应式为_______。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01molO2,丙中精铜增重_________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.可通过加成反应实现![]() 的转化
的转化
B.组成元素的质量分数相同,相对分子质量也相同的不同化合物,一定互为同分异构体
C.核磁共振氢谱、红外光谱都能够快速精确地测定有机物的相对分子质量
D.烯烃只能发生加成反应,不能发生取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应:CO(g)+2H2(g)![]() CH3OH(g),下列事实能说明此反应已达到平衡状态的是( )
CH3OH(g),下列事实能说明此反应已达到平衡状态的是( )
A.容器内气体密度保持不变
B.用CO、H2、CH3OH表示反应的速率之比为1:2:1
C.单位时间内生成nmolCO的同时生成2nmolH2
D.混合气体的平均相对分子质量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3-)的比值将减小
B.pH=1的一元酸和pH=13的一元碱等体积混合后溶液不一定呈中性
C.0.1mol/L硫酸铵溶液中:![]()
D.0.1mol/L的硫化钠溶液中:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )。
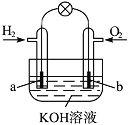
A.氢氧燃料电池是一种具有应用前景的绿色电源
B.a极是负极,该电极上发生氧化反应
C.总反应方程式为2H2+O2=2H2O
D.b极反应是O2+4OH--4e-=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com