
科目: 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目: 来源: 题型:
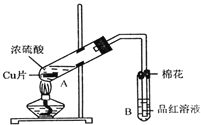
【题目】某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入![]() ,发现铜片溶解,反应的离子方程式为:______.
,发现铜片溶解,反应的离子方程式为:______.
(4)若仍不补充浓硫酸,只要求使铜片溶解,也可以加入![]() 填写两种属于不同类别物质的化学式
填写两种属于不同类别物质的化学式![]() ______、______.
______、______.
(5)![]() 试管口的棉花应沾有的试剂是______.
试管口的棉花应沾有的试剂是______.
小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体![]() 小组成员采用加热法测定该晶体里结晶水x的值.
小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
|
|
|
根据上表数据计算判断x的实测值比理论值![]() ______
______![]() 填“偏大”、“偏小”
填“偏大”、“偏小”![]() ,这次实验中产生误差的原因可能是______
,这次实验中产生误差的原因可能是______![]() 填序号
填序号![]()
A.硫酸铜晶体中含有不挥发的杂质![]() 实验前晶体表面有湿存水
实验前晶体表面有湿存水
C.加热时有晶体飞溅出去![]() 加热失水后露置在空气中冷却.
加热失水后露置在空气中冷却.
查看答案和解析>>
科目: 来源: 题型:
【题目】黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:(绿矾化学式为FeSO4·7H2O)
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n( Fe) ×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH一和Fe的物质的量。试回答下列问题。
(1)在绿矾中加人酸性介质的NaClO3目的是__________ 。
(2)SPFS溶于水后并与水反应生成__________ 能吸附水中的悬浮物来净化水。
(3)取15.05g某固体聚合硫酸铁溶解于水,向其中加人过量的BaCI2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀20.97g.向上述滤液中加人NH3H2O,调节溶液pH= 6,经过滤、洗涤、干燥得Fe2O3固体5.60g。该固体聚合硫酸铁的盐基度为_________ 。
(4)计算出该固体聚合硫酸铁样品的化学式______________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)工业上常用铝土矿冶炼金属铝。
①铝土矿的主要成分为![]() 和
和![]() ,其中
,其中![]() 属于____________(填“酸性”“碱性”或“两性”)氧化物;
属于____________(填“酸性”“碱性”或“两性”)氧化物;
②冶炼过程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“碱性”);
③利用金属活动性的不同,可以采用不同的冶炼方法,制取单质铝应采取_____________(填“热还原法”或“电解法”)。
(2)工业上合成氨的反应为:![]() ,一定条件下,将
,一定条件下,将![]() 和
和![]() 置于
置于![]() 的密闭容器中,
的密闭容器中,![]() 后测得
后测得![]() 为
为![]() 。
。
①用![]() 表示该反应的速率为___________;
表示该反应的速率为___________;
②其他条件不变时,再通入![]() ,该反应的速率将_____________(填“增大”或“减小”)。
,该反应的速率将_____________(填“增大”或“减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化不可用沉淀溶解平衡原理解释是( )
A.氢氧化亚铁浊液在空气中放置变红褐色
B.除去水垢中的![]() 要加入
要加入![]()
C.溶洞形成的过程中![]() 与
与![]() 之间的转化
之间的转化
D.含氟牙膏的使用降低了龋齿的发生率
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应2SO2(g)+O2(g)![]() 2SO3(g)是硫酸制造工业的基本反应。将0.050 mol SO2(g)和0.030mol O2(g)注入体积为1.0L的密闭反应器,并置于某较高温度下的恒温环境中,达化学平衡后,测得反应器中有0.040 mol SO3(g),求该温度下反应的平衡常数及SO2、O2的平衡转化率________。
2SO3(g)是硫酸制造工业的基本反应。将0.050 mol SO2(g)和0.030mol O2(g)注入体积为1.0L的密闭反应器,并置于某较高温度下的恒温环境中,达化学平衡后,测得反应器中有0.040 mol SO3(g),求该温度下反应的平衡常数及SO2、O2的平衡转化率________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.高锰酸钾溶液中,![]() 、
、![]() 、
、![]() 、葡萄糖分子能够大量共存
、葡萄糖分子能够大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() ,充分反应的离子方程式:
,充分反应的离子方程式:![]()
C.某温度下,![]() 的
的![]() 与
与![]() 混合溶液,一定存在
混合溶液,一定存在![]()
D.![]() ,已知
,已知![]() ,在
,在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答问题:
(1)写出E的基态原子的电子排布式___________。
(2)含有元素D的盐的焰色反应为____色,许多金属形成的盐都可以发生焰色反应,其原因是__________________________________________。
(3)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为____________________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(4)G与C可形成化合物GC和G2C,已知GC在加热条件下易转化为G2C,试从原子结构的角度解释发生转化的原因________________________。
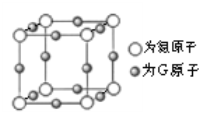
(5)G与氮元素形成的某种化合物的晶胞结构如下图所示,则该化合物的化学式为__________,氮原子的配位数为__________。若晶体密度为a g·cm-3,则G原子与氮原子最近的距离为__________pm(写出数学表达式,阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com