
科目: 来源: 题型:
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
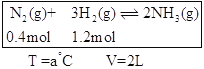
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
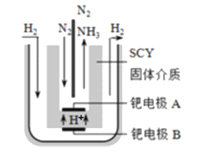
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
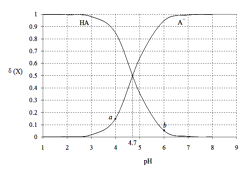
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的是
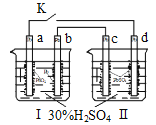
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下对于可逆反应![]() ,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
物质 | X | Y | Z |
初始浓度(mol·L-1) | c1 | c2 | c3 |
平衡浓度(mol·L-1) | 0.2 | 0.3 | 0.12 |
则下列判断正确的是( )
A.c1∶c2=2∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为2:3
D.c1的取值范围为0<c1<0.3
查看答案和解析>>
科目: 来源: 题型:
【题目】用铂电极电解CuSO4和Al2(SO4)3的混合液一段时间后,往溶液中加入0.5mol Cu2(OH)2 CO3恰好使溶液复原,则电解过程转移的电子的物质的量为( )
A.1 molB.2 molC.3 molD.4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸(HCOOH)是一种常见的一元弱酸,在水溶液中存在如下电离平衡:HCOOH![]() H++HCOO-,下列有关说法不正确的是
H++HCOO-,下列有关说法不正确的是
A.在该溶液中,c(H+)略大于c(HCOO-)
B.向该溶液中加入NaOH固体,电离平衡正向移动,pH值增大
C.将氯化氢气体通入溶液中,平衡逆向移动,c(HCOO-)增大
D.将溶液加水稀释,c(OH-)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,将![]() 气体通入
气体通入![]() 的NaOH溶液中,下列对所得溶液的描述不正确的是( )
的NaOH溶液中,下列对所得溶液的描述不正确的是( )
A.当![]() 时,所得溶液中一定存在:
时,所得溶液中一定存在:![]()
B.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
C.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
D.当![]() 时,所得溶液中存在:
时,所得溶液中存在:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界稀土资源大国,稀土元素是镧系、钪![]() 、钇
、钇![]() 种元素的总称,它们位于元索周期表中同一副族。
种元素的总称,它们位于元索周期表中同一副族。
![]() 原子的价层电子排布式为______,第一电离能Sc______Y
原子的价层电子排布式为______,第一电离能Sc______Y![]() 填“大于”或“小于”
填“大于”或“小于”![]() 。
。
![]() 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈![]()
![]() 精矿制得:
精矿制得:
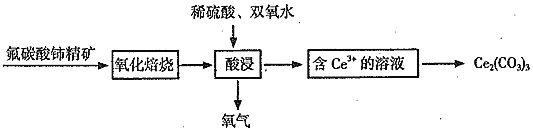
![]() 中,Ce的化合价为______。
中,Ce的化合价为______。
![]() 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈![]() ,其在酸浸时发生反应的离子方程式为______。
,其在酸浸时发生反应的离子方程式为______。
![]() 离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大
离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则
,则![]() 中的大
中的大![]() 键应表示为______。
键应表示为______。
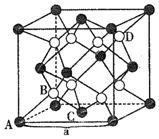
![]() 常温、常压下
常温、常压下![]() 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。![]() 晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数
晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数![]() 0,
0,![]() ;
;![]() :
:![]() ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数![]() 0,
0,![]() ,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长
,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长![]() ,其密度为______
,其密度为______![]() 列出计算式即可
列出计算式即可![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年春节前后,世界各地爆发了新型冠状病毒疫情。在疫情面前,我国人民众志成城,奋力战疫。
(1)疫情期间,更应合理饮食。山西人喜欢以“面”为主食,“面”中富含的营养物质是___,面在人体中各种酶的作用下发生水解,最终生成___(填化学式),与其互为同分异构体的一种物质的名称是___。
(2)加强锻炼,增强体质,是抗疫的最佳途径。通过锻炼可以消耗身体内多余脂肪,脂肪在人体中所起的主要作用是___。
(3)医用口罩中对阻挡病毒起关键作用的是熔喷布(主要原料是聚丙烯),由丙烯(CH3CH=CH2)在一定条件下制取聚丙烯的化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com