
科目: 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
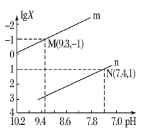
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
查看答案和解析>>
科目: 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究。完成下列空格。
①提出假设:
假设1:只存在Fe2O3;假设2:_________;假设3:既存在Fe2O3也存在Cu2O。
②查找资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
③实验方案设计与分析:
方案一:步骤一:取少量样品于烧杯中,加入过量浓硝酸,产生一种红棕色的气体。由此可得出假设____不成立,写出产生上述气体的化学方程式___________________。
步骤二:取少量步骤一溶液置于试管中滴加_______,振荡,若________,则说明假设3成立。
方案二:
取少量样品于烧杯中,加入过量稀硫酸,若固体全部溶解,说明假设_不成立。
方案三:

同学们设计了如下实验方案测定该样品中Fe2O3的质量分数(装置气密性良好,假设样品完全反应):
步骤一:取样品并称量该样品的质量为m1;
步骤二:测出反应前广口瓶和瓶内物质总质量m2;
步骤三:测出反应后广口瓶和瓶内物质总质量m3;
步骤四:计算得出矿物样品中Fe2O3的质量分数。
讨论分析:该实验方案________(填“能”或“不能”)测出矿物中Fe2O3的质量分数。不改变装置和药品,通过计算得出矿物中Fe2O3的质量分数,你还可以通过测定_______。若测得m1为3.04g,m3=m2+1.76g,则原样品中Fe2O3的质量分数为_____(结果保留四位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
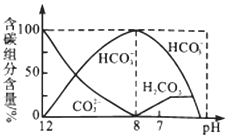
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2: 1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Ksp[(CH3)2NH)]=l.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定二甲胺溶液的曲线
B. a点溶液中:c[(CH3)2NH2+]>c[CH3]2NH·H2O]
C. d点溶液中:c(H+)=c(OH-)+c[CH3]2NH·H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是b点
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸工业的重要反应之一:2SO2(g)+O2(g)![]() 2SO3(g)下列叙述不正确的是( )
2SO3(g)下列叙述不正确的是( )
A.其他条件不变,升高温度可增大SO3的生成速率
B.使用合适的催化剂,是为了增大化学反应速率
C.该反应达到化学平衡状态时,SO2可100%转化为SO3
D.该反应达到化学平衡状态时,SO3的浓度不再改变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
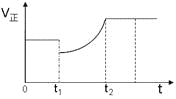
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 胶体与溶液的本质区别在于是否可以发生丁达尔现象
B. 在常温下铁遇浓硫酸会钝化,所以可以用铁制容器来装运浓硫酸
C. 氯气具有漂白性,可以使湿润的有色布条褪色
D. 二氧化碳通入足量澄清石灰水中,没有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】已知电离常数的负对数pK=-lgK,25℃时,HX的pKa=4.76,H2Y的pKa1=1.22,pKa2=4.19,下列说法正确的是( )
A.浓度相等的NH4X和NH4HY溶液中c(NH4+):前者大于后者
B.NaX溶液中滴加KHY溶液至pH=4.76:c(K+)+c(Na+)>c(HY-)+2c(Y2-)+c(X-)
C.KHY溶液中滴加氨水至中性:c(NH4+)>c(Y2-)
D.K2Y溶液中滴加盐酸至pH=1.22:c(Cl-)-3c(HY-)=c(H+)-c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是( )
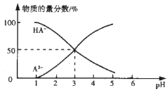
A.H2A的电离方程式为H2A=HA-+H+ HA-A2-+H+
B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)<0.1mol/L
D.常温下,等物质的量浓度NaHA与Na2A溶液等体积混合后溶液的pH=3.0
查看答案和解析>>
科目: 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com