
科目: 来源: 题型:
【题目】某温度下,水的离子积约为1×10-12,将VaL pH=2的硫酸溶液与VbL pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 ( )
A. 2∶11B. 2∶9C. 11∶2D. 9∶2
查看答案和解析>>
科目: 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
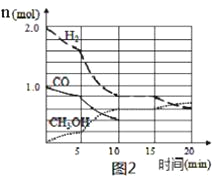
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。室温下向10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液。如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )

A.A点所示溶液的c(H+)=5.6×10-11
B.B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L
C.A点→B点发生反应的离子方程式为CO32-+H+=HCO3-
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度(t ℃)时,水的Kw=1×10-12,则该温度____(填“>”“<”或“=”)25 ℃,其理由是_________________________________________________________。
(2)该温度下,c(H+)=1×10-7 mol/L的溶液呈_____(填“酸性、碱性或中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________ mol/L。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______(填“向左” “向右”或“不”,下同 )移动。在新制氯水中加入少量的NaCl固体,水的电离平衡________移动。
(4)25 ℃时,pH=4的盐酸中水的电离程度________(填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的电离程度。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有希望成为新能源汽车的电源,其结构如图所示,下列说法正确的是( )

A.电子从金属锂流出通过外电路流向石墨烯,固体电解质允许通过水
B.放电时,正极反应式:O2+4e-+4H+=2H2O
C.应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目: 来源: 题型:
【题目】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__。
(2)用盐酸酸浸时发生反应的离子方程式为:__,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,在某物质的溶液中,由水电离出的
时,在某物质的溶液中,由水电离出的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 时,水的电离受到抑制
时,水的电离受到抑制
B.![]() 时,水的电离受到抑制
时,水的电离受到抑制
C.![]() 时,溶液的pH一定为a
时,溶液的pH一定为a
D.![]() 时,溶液的pH一定为
时,溶液的pH一定为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
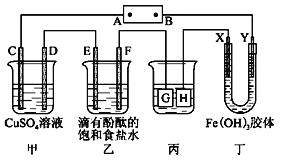
请回答:(1)B极是电源的___极,电极C的电极反应式为:___。
(2)若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)现用丙装置给铜件镀银,则H电极材料是___(填“铜”或“银”),电镀液是___溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为___。
(4)一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__在电场作用下向Y极移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时Ksp(BaSO4)=1.0×1010。该温度下,CaSO4悬浊液中c(Ca2+)与c(SO42)的关系如图所示,下列叙述正确的是( )

A.向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同
B.a、b、c、d四点对应的体系中,d点体系最稳定
C.升高温度后,溶液可能会由a点转化为b点
D.反应Ba2+(aq) + CaSO4(s)![]() BaSO4(s) + Ca2+(aq)的平衡常数K=9×104
BaSO4(s) + Ca2+(aq)的平衡常数K=9×104
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇在生产生活中有着广泛的用途。
(1)乙醇的官能团是_______。
(2)工业生产中,用乙烯与水反应制得乙醇,该反应类型为_________。
(3)乙醇与乙酸反应可制得香料乙酸乙酯,乙酸乙酯的结构简式为___________。
(4)乙醇在铜作催化剂条件下可被氧化为乙醛,写出反应的化学方程式__________。
(5)交警常使用酒精检测仪来检验机动车司机是否酒驾,其原理是:司机口中呼出的乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O7)转变为绿色的硫酸铬[Cr2(SO4)3],上述反应涉及的乙醇性质有________。
A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com