
科目: 来源: 题型:
【题目】下列叙述正确的是![]()
①含有大量![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
②![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 可以大量共存
可以大量共存
③向![]() 溶液中加入过量的稀氨水,发生反应:
溶液中加入过量的稀氨水,发生反应:![]()
④加入铝粉能放出![]() 的溶液中,
的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 一定能够大量共存
一定能够大量共存
⑤用NaOH溶液除去铝条表面的氧化膜:![]()
⑥依据铝热反应原理,能发生反应
⑦向明矾溶液中加入过量![]() 溶液,发生反应:
溶液,发生反应:![]()
⑧常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.⑤⑦B.②③⑤C.④⑤⑥D.②⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)如果按图中所示的装置进行试验,求得的中和热数值_______(填“偏大、偏小、无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与(2)中实验相比,所求中和热_________ (填“相等”或“不相等”)。
Ⅱ: (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。已知:C3H8(g) === CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g)=== CH4(g)+ HC≡CH(g ) △H2=+32.4 kJ·mol-1
则C3H8(g) === CH3CH=CH2(g)+H2(g) △H =______________ kJ·mol-1。
(2)发射火箭时用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:____________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于取代反应的是( )
A.CH2=CH2+Br2→CH2BrCH2Br
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.C3H8 + 5O2 ![]() 3CO2 + 4H2O
3CO2 + 4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】某工业废水含有![]() 和
和![]() 等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
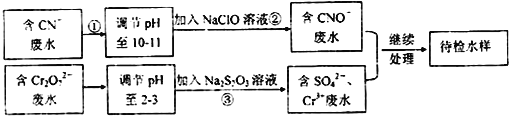
回答下列问题:
![]() 步骤
步骤![]() 中,
中,![]() 被
被![]() 氧化为
氧化为![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 步骤
步骤![]() 的反应方程式为
的反应方程式为![]() 未配平
未配平![]() ,则每消耗
,则每消耗![]()
![]() ,反应中
,反应中![]() 失去
失去![]() ______ mo1.
______ mo1.
![]() 含
含![]() 废水可以加入熟石灰进一步处理,目的是 ______ .
废水可以加入熟石灰进一步处理,目的是 ______ .
![]() 在
在![]() 下,将a
下,将a![]() 的NaCN溶液与
的NaCN溶液与![]() 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液![]() ,用含a的代数式表示
,用含a的代数式表示![]() 的水解常数
的水解常数![]() ______
______ ![]() 若
若![]() 时将浓度均为
时将浓度均为![]() 的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______
的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______ ![]() 填字母
填字母![]() .
.
![]() 此溶液一定有
此溶液一定有![]()
![]() 此溶液一定有
此溶液一定有![]()
C 混合溶液中水的电离程度一定大于该温度下纯水的电离程度
![]() 此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
![]() 利用
利用![]() 通过下列方法测定某锡粉的纯度
通过下列方法测定某锡粉的纯度![]() 杂质不参与反应
杂质不参与反应![]() :取ag锡粉溶于盐酸中,向生成的
:取ag锡粉溶于盐酸中,向生成的![]() 中加入过量的
中加入过量的![]() 溶液,用b
溶液,用b![]()
![]() 滴定生成的
滴定生成的![]() 已知酸性环境下,
已知酸性环境下,![]() 可被还原为
可被还原为![]() ,共用去
,共用去![]() 溶液m
溶液m![]() 则锡粉中锡的质量分数是 ______
则锡粉中锡的质量分数是 ______ ![]() 的摩尔质量为M
的摩尔质量为M![]() ,用含a、b、m、M的代数式表示
,用含a、b、m、M的代数式表示![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3=__________(用含ΔH1、ΔH2的代数式表示)。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
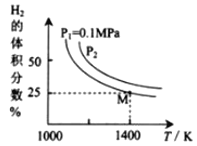
①由图可知,该反应的ΔH______0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
①![]()
![]() 和
和![]() 的混合气体中含有的原子个数为
的混合气体中含有的原子个数为![]()
②常温下,4g ![]() 含有
含有![]() 个
个![]() 共价键
共价键
③![]() 质量分数为
质量分数为![]() 的
的![]() ,加水至100mL,
,加水至100mL,![]() 的质量分数为
的质量分数为![]()
④标准状况下,![]() 四氯化碳含有的分子数为
四氯化碳含有的分子数为![]()
⑤![]() 时,
时,![]() 的
的![]() NaClO溶液中水电离出的
NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
⑥![]() 溶液中含有
溶液中含有![]() 个
个![]()
⑦![]()
![]() 与水完全反应时转移电子数为
与水完全反应时转移电子数为![]()
A.③⑥⑦B.①②④C.①②⑤D.④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com