
科目: 来源: 题型:
【题目】已知:25℃时,碳酸(H2CO3)的电离常数Ka1=4.5×10-7、Ka2=5.0×10-11。常温下,向20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1的盐酸40mL,溶液中含碳元素各微粒(CO2因逸出未画出)的物质的量分数随溶液pH的变化如图所示,下列说法错误的是( )

A.随着盐酸的加入,溶液中![]() 的值增大
的值增大
B.加入盐酸至溶液pH=8的过程中,水的电离程度逐渐减小
C.当pH=7时,溶液中c(Na+)>c(HCO3-)>cCl-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.l.0molL-1NaClO溶液:Fe2+、K+、I-、Cl-
B.1.0molL-1的NaAlO2溶液:K+、Ba2+、Cl-、HCO3-
C.由水电离出的c(OH-)=1×10-12molL-1的溶液:NH4+、HCO3-、Na+、Cl-
D.![]() =1×10-14的溶液:K+、Na+、Cl-、SiO32-
=1×10-14的溶液:K+、Na+、Cl-、SiO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
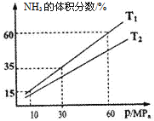
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;列出计算式即可,无需化简)。
②T1_____________T2(填“>”、“<”或“=”)。
③达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将______(填“增大”“减小”或“不变”)
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H
NH*;NH*+H![]() NH2*;NH2* +H*
NH2*;NH2* +H*![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
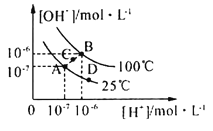
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0. 100 mol L-1 的盐酸滴定 0.1 00 molL-1 的氨水,其滴定曲线如图所示:
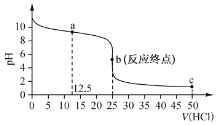
下列说法正确的是
A. 该滴定操作可用甲基橙作指示剂
B. a 点溶液中:c(NH4+)>c(NH3 H2O)>c(Cl- )
C. c 点溶液中:c(Cl-)>c(NH4+)>c(H+)
D. a→c过程中锥形瓶内水的电离度不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
科目: 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若定义pc是溶液中溶质的物质的量浓度的负对数,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示(已知:H2C2O4HC2O4-+H+ Ka1;HC2O4- C2O42-)+H+ Ka2)。则下列说法正确的是( )

A.pH=4时,c(HC2O4-)<c(C2O42-)
B.常温下,Ka1=10-0.7
C.pH=3~5.3的过程中水的电离程度增大
D.常温下,![]() 随pH的升高先增大后减小
随pH的升高先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g) ![]() 2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
A.①②③④ B.①③ C.④② D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol CH4含有的电子数为NA
B.标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA
C.1 mol丙烯醛分子中含有的双键数为NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com