
科目: 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
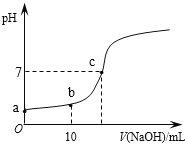
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中加入等物质的量的A、B,发生如下反应:2A(g)+2B(g) ![]() 3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
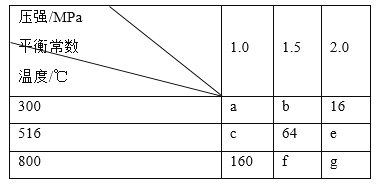
下列判断正确的是( )
A.g>f
B.ΔH<0
C.2.0MPa、800℃时,A的转化率最小
D.1.5MPa、300℃时,B的转化率为50%
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,Y的原子半径是短周期主族元素中最大的,元素W的最外层电子数是次外层的2.5倍,元素X的最外层电子数是电子层数的3倍,元素Z的单质,通常为黄绿色气体,与Y的最高价氧化物的水化物反应的产物可作漂白剂和消毒剂。
(1)元素W、X、Y、Z的符号分别是______,______,______,______。
(2)实验中制备Z单质的反应方程式为 ________________________。
(3)Z单质与X的氢化物发生反应的化学方程式为 __________________ 。若将干燥的有色布条放入Z的单质中,观察到的现象是 ___________________,原因是__________。
(4)Z单质与Y的最高价氧化物的水化物反应的化学方程式是_______,该反应中2mol Z完全反应时转移电子的数目_______ NA。
(5)实验中制备W的氢化物的反应方程式为 _________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用14.2g无水硫酸钠配制成500 mL溶液,其物质的量浓度为______mol/L。
(2)若配制溶液时操作如图所示,浓度_______(偏高,偏低,不变)。

(3)若从上述溶液(正确配置)中取出10 mL,则这10 mL溶液的物质的量浓度为______mol/L,含溶质的质量为_______g。
(4)若将上述10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为_________mol/L;若将稀释后溶液中的![]() 全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液___________mL。
全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液___________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D四种物质都是气体,现在5L的密闭容器中进行反应:4A+5B![]() 4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
A.反应开始至30s,v(A)=0.010mol·L-1·s-1
B.30s时容器中D的物质的量至少为0.45mol
C.30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D.反应开始至30s,容器中A的物质的量增加了0.30mol
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
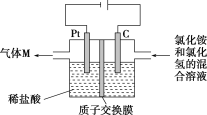
A. 每生成1 mol NCl3,理论上有4 mol H+经质子交换膜右侧向左侧迁移
B. 可用湿润的淀粉KI试纸检验气体M
C. 石墨极的电极反应式为NH4++3Cl--6e-= NCl3 +4H+
D. 电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:3A(g)+B(g)![]() 2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为________,此温度下的平衡常数K=________。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向________(填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比![]() 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率________;若将C分离出来,化学平衡常数________。(填“增大”、“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com