
科目: 来源: 题型:
【题目】将mg铜粉和锌粉的混合物分成两等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L(标准状况下);将另一份在空气中充分加热,的到n g固体,将所得固体溶于上述稀硝酸,消耗硝酸的体积为V ml。下列说法不正确的是
A.V=150Ml
B.硝酸的浓度为2 mol·L-1
C.m g铜粉和锌粉的物质的量之和为0.3 mol
D.n=m+2.4
查看答案和解析>>
科目: 来源: 题型:
【题目】柠檬酸是常用除水垢剂,可从柠檬中提取。柠檬酸由C、H和O三种元素组成,其分子结构如图所示。有关说法不正确的是( )

A.柠檬酸溶液可以和水垢中Mg(OH)2和CaCO3反应
B.在加热和浓硫酸条件下,柠檬酸可与CH3CH2OH反应
C.在加热和浓硫酸条件下,柠檬酸可与CH3COOH反应
D.在加热和镍催化条件下,柠檬酸可以和H2反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJmol1
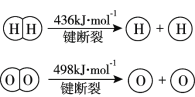
下列说法不正确的是
A.该反应可作为氢氧燃料电池的反应原理
B.破坏1 mol H-O键需要的能量是463.4 kJ
C.H2的燃烧热ΔH<-241.8 kJ·mol1
D.H2(g)中的H-H键比H2O(g)中的H-O键牢固
查看答案和解析>>
科目: 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
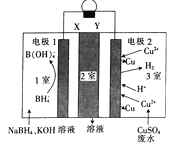
A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目: 来源: 题型:
【题目】将铜片和锌片用导线连接并插入稀硫酸中,锌片的表面有少量气泡产生并逐渐溶解变薄。铜片没有溶解现象,但表面出现大量气泡,经检测上述气体的成分均为H2。在导线上检测到有持续的电流产生。基于上述现象,下列推测不合理的是( )

A.负极(锌片)区域只发生了氧化反应
B.H+还原所需的电子均由Zn提供
C.电子从锌经导线迁移向铜而产生电流
D.生成的H2由溶液中H+还原得到
查看答案和解析>>
科目: 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是__。
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是__。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)本实验所得到的环己烯产率是__(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列实验现象所进行的解释不合理的是( )
选项 | 现象和事实 | 解释 |
A | 乙烯通入溴的四氯化碳溶液,溴的四氯化碳溶液橙红色褪色 | 乙烯和四氯化碳溶液中的溴发生加成反应,生成无色的1,2-二溴乙烷 |
B | 海轮船壳外侧焊接大量锌块,能有效减缓钢铁船壳在海水中的腐蚀速率 | 锌和铁在海水中构成原电池,锌作负极提供电子,从而保护了钢铁 |
C | 将大理石颗粒加入盐酸中,反应生成气体的速率先逐渐加快后逐渐减慢 | 开始阶段反应放热,溶液温度升高;后期反应吸热,溶液温度下降 |
D | 在AgNO3溶液中加入过量NaCl溶液,静置后,在上层清液中仍检测到Ag+ | Ag+和Cl-的沉淀反应为可逆反应,受反应限度制约,Ag+不能完全沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,其质谱图如图所示,则:
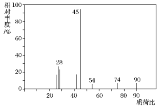
(1)C的分子式是___。
(2)若C能与NaHCO3溶液发生反应,则C中一定含有的官能团名称是_____。又知C分子的核磁共振氢谱有4个峰,峰面积之比是1∶1∶1∶3,则C的结构简式是_____。写出C与NaHCO3溶液反应的化学方程式__。
(3)0.1molC与足量Na反应,在标准状况下产生H2的体积是_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图某有机物的结构简式为:
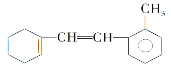
①1mol该物质和溴水反应,消耗Br2的物质的量为__mol;
②该物质与足量氢气完全加成后环上的一氯代物有__种;
(2)现有六种有机物,请回答下列问题:
A.![]() B.
B.![]() C.
C.![]() D.
D.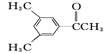 E.
E.![]() F.
F.![]()
①上述化合物中互为同分异构体的是__;互为同系物的是__。
②A物质中含有的官能团名称为__。
③D的一氯代物最多有__种。
查看答案和解析>>
科目: 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
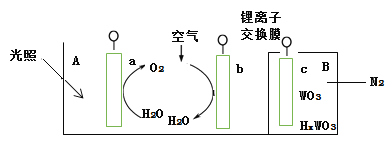
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com