
科目: 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:乙![]() 丙
丙![]() 丁
丁
B.单质的还原性:丁![]() 丙
丙![]() 甲
甲
C.乙、丙、丁的最髙价氧化物对应的水化物能相互反应
D.甲、乙、丙的氧化物均为共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂电池充电时阳极反应式为:LiFePO4 -xLi+ -xe-→ xFePO4 + (1-x)LiFePO4。放电工作示意图如下图。下列叙述不正确的是

A.放电时,Li+ 通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4
D.该电池充放电过程通过Li+ 迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
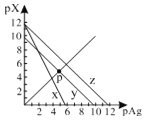
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是化学家为纪念元素周期表诞辰150周年而绘制的一种新型元素周期表。在该表中能直观地看出各种元素在地球上的丰度(丰度即该元素占地球所有原子总数的百分比。用该元素所在格子的面积表示丰度的相对大小)。

(1)在图中找到地球上含量最多的元素。其原子结构示意图为___,海水中含量最多的金属离子的结构示意图为___。
(2)宇宙中含量最多的元素为氢元素。氢元素有多种同位素,其中原子核内含有2个中子的核素可表示为___。水分子的电子式为___。
(3)H、C、O和N等丰度较大的元素是构成地球生命物质的主要“材料”。
①H、C、O和N的原子半径从大到小的顺序为___。
②下列与生命活动有关的物质中一定含有H、C、O和N四种元素的是___。
a.蛋白质 b.糖类 c.油脂
(4)Al是地壳中含量最多的金属元素。Al2O3和Al(OH)3均为两性化合物。Al(OH)3和盐酸反应的离子方程式为___,Al(OH)3和NaOH溶液反应的化学方程式为___。试运用元素周期律分析Al2O3和Al(OH)3均为两性化合物的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com