
科目: 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:

请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO![]() 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列做法符合原子经济性原理的是
A.SO3与H2O反应制取硫酸:SO3+H2O=H2SO4
B.用氢氧化钠溶液吸收SO2:SO2+2NaOH=Na2SO3+H2O
C.CO2与H2反应制取甲醇:CO2+3H2 CH3OH+H2O
CH3OH+H2O
D.H2还原氧化铜:H2+CuO![]() Cu+H2O
Cu+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) H<0。
2SO3(g) H<0。
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:_______。
(2)某兴趣小组在实验室对该反应进行研究,在一密闭容器内加入一定量的SO2和O2,部分实验图像如图1

① 该反应的平衡常数表达式为___________________。
② t1、t2、t3中,达到化学平衡状态的是________________。
③ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________________。
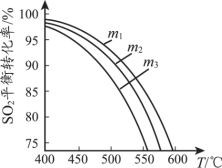
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m[m=n(SO2)/n(O2)] 不同时,SO2的平衡转化率与温度(T)的关系如图所示,则m1、m2、m3的从大到小的顺序为___________________。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH-)=_______mol·L1。将原料气SO2和O2通入该氨水中,当c(OH-)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=____。
)=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组探究酸雨对低碳钢腐蚀的影响,实验流程如图:

实验使用了3种模拟酸雨。模拟酸雨中的离子浓度如表所示,其中平衡电荷的阳离子以NH![]() 或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。
或Na+补充,实验均在室温下进行,低碳钢片样品的大小和质量均相同。

(1)将模拟酸雨1和模拟酸雨2进行对比实验,实验的目的是___。模拟酸雨3对钢片的腐蚀速率大于模拟酸雨2对钢片的腐蚀速率,可以得到结论是___。
(2)在用模拟酸雨2进行实验时,腐蚀冲洗液中检测到Fe2+和NH![]() 的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
的含量升高。腐蚀时硝酸和铁反应的离子方程式为___。
(3)在上述三组腐蚀实验中,都检测到钢片内部持续产生腐蚀电流。产生腐蚀电流的原因是___。
(4)钢铁的腐蚀研究中,通常用“腐蚀速率(单位为mg·h-1)"对钢铁腐蚀过程和结果进行评估。则计算“腐蚀速率”需要测量的实验数据为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】PET(聚对二苯甲酸乙二醇酯)是制备医用防护服的重要材料。以石油作为原料合成PET中间体的流程如图:
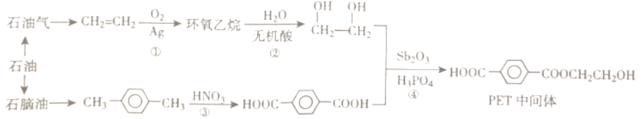
(1)环氧乙烷的分子式为C2H4O,分子中存在一个环状结构。环氧乙烷的结构简式为___,环氧乙烷有多种同分异构体,下列结构与环氧乙烷互为同分异构体的是___ (填代号)
a.CH3CHO b.HOCH2CH2OOH c.CH2=CHOH
(2)反应②的产物是乙二醇。乙二醇属于醇类化合物,性质与乙醇类似。乙二醇的官能团是___。(填名称或者结构简式)
(3)从石脑油中可以提炼出对二甲苯(![]() )。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
)。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
(4)反应④的化学方程式为___。该反应的反应类型为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.请回答下列问题:
(1)TiCl4水解生成TiO2x H2O的化学方程式为____________________________________.
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号)

(3)滴定分析时,称取TiO2(摩尔质量为M gmol-1)试样w g,消耗c molL-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为______.
(4)判断下列操作对TiO2质量分数测定结果的影响(填 “偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果______.
查看答案和解析>>
科目: 来源: 题型:
【题目】染料化工企业产生的废水中含有高浓度的氨氮(氨和铵盐)成分,直接排放会造成环境污染。实验小组探索下列方法对氨氮废水进行处理。

(1)实验室检测上述废水中是否含有氨氮的方法是___。
(2)“吹脱”步骤中,在废水池的底部吹入大量热气泡,其目的是___。
(3)“氧化”步骤中加入了微生物,NH3被氧化为N2。反应的化学方程式为___。
(4)“沉淀"步骤中将剩余的NH3·H2O转化为NH4MgPO46H2O沉淀,发生反应的离子方程式为___。NH4MgPO46H2O在农业生产中具有重要应用价值,其原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是_____________(填字母).
a、溶液中c(H+)>c(OH) b、NH4+水解是微弱的
c、NH3H2O是弱碱 d、由H2O电离出的c(H+)<107mol/L
e、物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

①表示滴定盐酸的曲线是____________(填序号).
②滴定醋酸溶液的过程中:
i、V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为________________________.
ii、当c(Na+)=c(CH3COO)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”).
Ⅱ.复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1molL1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是______(填编号).
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05molL1的下列5种物质的溶液中,pH最小的是______(填编号),其pH值为______(填数值);pH最大的是______(填编号).
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com