
科目: 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
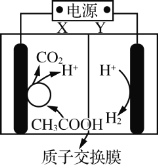
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化曲线如下图所示,按要求解决下列问题。

(1)该反应的化学方程式为:_________________________________;
(2)用A表示的反应速率为:___________________;
(3)下列条件改变时,能加快化学反应速率的是_________请填代号)
A.扩大容器的容积 B.增大C的用量
C.降低体系的温度 D.加入催化剂
(4)该反应达到化学反应限度时,B的转化率为____________。(请保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
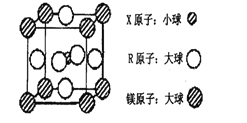
查看答案和解析>>
科目: 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
科目: 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组在某温度下测定溶液的pH时发现0.01mol/L 的NaOH溶液中,由水电离出的c(H+)c(OH-)=10-22,该探究小组将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:10混合,混合后所得溶液恰好呈中性,若x=![]() y,则x为( )
y,则x为( )
A.2B.3C.4D.5
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
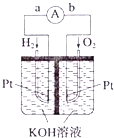
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用![]() 的
的![]() 溶液滴定
溶液滴定![]()
![]() 的
的![]() 溶液,水的电离程度随
溶液,水的电离程度随![]() 溶液体积的变化曲线如图所示。下列说法正确的是( )
溶液体积的变化曲线如图所示。下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.从![]() 点到
点到![]() 点,溶液中水的电离程度逐渐增大
点,溶液中水的电离程度逐渐增大
C.![]() 点溶液中
点溶液中![]()
D.![]() 点对应的
点对应的![]() 溶液的体积为
溶液的体积为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com