
科目: 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
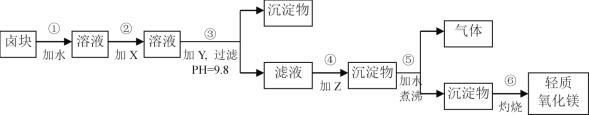
表1
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽
表2
物质 | 价格(元/吨) |
漂白液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,回答下列问题:
(1)步骤②中加入的试剂X,最佳选择_____________(填物质名称),其作用是___________________。
(2)步骤③生成的沉淀物含有____________________(填化学式)。
(3)步骤⑤中发生反应的化学方程式为_____________________________。
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、________和泥三角。
(5)在实验室中,为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是____________(填字母)。
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ molL-1 | 体积/mL | 浓度/ molL-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ molL-1min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。
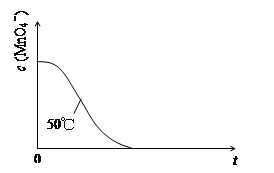 _____________
_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g) ![]() C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
C(g)+xD(g),5s达到平衡。达到平衡时,生成了1mol C,测定D的浓度为1mol/L。
(1)求x =____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时B的浓度为______。
(4)求该温度下反应平衡常数为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式___________________________________。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂 N2O4反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和 N2O4反应的热化学方程式___________________。
(3)饮用水中的 NO3-主要来自 NH4+。已知在微生物的作用下,NH 4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如图:
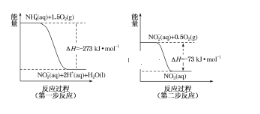
1mol NH 4+全部被氧化成 NO3-的热化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)氯化铝水溶液呈________(填“酸”、“中”或“碱”)性,原因是(用离子方程式表示)________________________________________;
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的__________(填化学式)。
(3)已知纯水在T℃时,pH=6,该温度下某NaOH溶液的浓度为1 mol·L-1,则该溶液由水电离出的c(OH-)=________mol·L-1。
(4)常温下,浓度均为0.1 mol/L的五种溶液的pH如下表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
根据表中数据,回答问题:
①常温下,等浓度的下列四种酸溶液,pH最小的是______;
A.HCN B.HClO C.H2CO3 D.CH3COOH
②等体积等浓度的NaCN、NaClO两溶液中所含阴、阳离子总数的大小关系为__。
A.前者大 B.相等 C.后者大 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清透明溶液中只可能含有①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥
,⑥![]() ,⑦
,⑦![]() 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
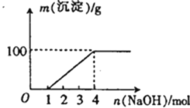
A.②⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦D.①②③④⑤⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com