
科目: 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
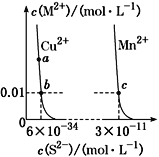
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作或处理事故的方法正确的是( )
A.用干燥的pH试纸测定NaClO溶液的pH
B.在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
C.用分液漏斗分离乙酸乙酯和水的混合物时,水从下口放出,乙酸乙酯从上口倒出
D.欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中
查看答案和解析>>
科目: 来源: 题型:
【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡OH-正向移动,n(OH-)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别加入0.3 g锌粉,醋酸生成的氢气比盐酸多
D.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中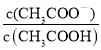 值增大
值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,10 mLpH=1的醋酸溶液中含有的氢离子数为0.001NA
B. 合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目等于NA
D. 常温常压下,18.4gNO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
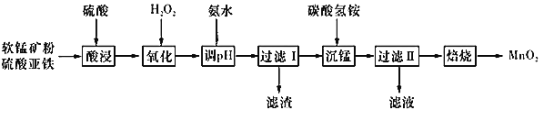
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1)实验室预计需要使用480 mL 2 mol·L-1的硫酸,准备用18.4 mol·L-1的浓硫酸来配制,需用量筒量取浓硫酸________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)加入硫酸亚铁的原因为_____________________________。
(3)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_____________(用离子方程式表示)。“酸浸”时为加快反应速率可采取的措施是_____________________(至少写两个)。
(4)加入氨水应调节pH的范围为_______。“过滤II”所得滤渣为MnCO3,滤液中溶质的主要成分是_______(填化学式)
(5)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_________。
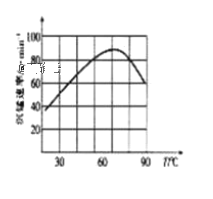
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制备高纯度的硫酸锰晶体,其流程如下图所示:
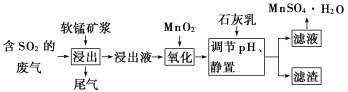
已知:
①浸出液中的金属阳离子主要是![]() ,还含有少量的
,还含有少量的![]() 、
、![]() 等,且
等,且![]() .
.
②几种离子开始沉淀和完全沉淀时的pH如表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.7 |
| 2.7 | 3.7 |
| 3.8 | 4.7 |
| 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:_____________.
(2)用离子方程式表示加入二氧化锰的作用:________________________________.
(3)从表中数据来看,________(填“能”或“不能”)取消“加入二氧化锰”的步骤,原因是________________________.
(4)下列试剂能替代二氧化锰的是________(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(5)有同学认为可以用碳酸锰![]() 或氢氧化锰
或氢氧化锰![]() 替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
(6)从含硫酸锰的滤液中提取硫酸锰晶体的操作是_____________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染.PETG的结构简式如下:
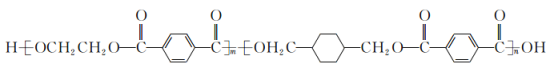
这种材料可采用下图所示的合成路线;
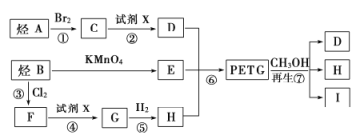
已知;(1)![]()
(2)![]() (R、
(R、![]() 、
、![]() 表示烃基)
表示烃基)
请回答下列问题:
(1)⑦的反应类型是_____________,试剂X为_____________.
(2)写出Ⅰ的结构简式:____________
(3)合成时应控制的单体的物质的量:![]() _____________(用m,n表示).
_____________(用m,n表示).
(4)写出反应②的化学方程式:____________________________________.
(5)与E的分子式相同,且满足下列条件的同分异构体有_____________种.
①能与![]() 溶液反应产生
溶液反应产生![]() ②能发生银镜反应 ③遇
②能发生银镜反应 ③遇![]() 溶液显紫色
溶液显紫色
(6)D和E在催化剂作用下可生产一种聚酯纤维——涤纶,请写出生产该物质的化学方程式:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”)。
(3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com