
科目: 来源: 题型:
【题目】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的Fe2+含量,请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式_________(K2Cr2O7被还原为Cr3+)。
(2)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取K2Cr2O7________ g(保留四位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器一定不会用到的有________。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(3)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将____________________________。
(4)用0.010 00 mol·L-1的K2Cr2O7溶液滴定20.00 mL未知浓度的含Fe2+的溶液。恰好完全反应时消耗10.00 mL K2Cr2O7溶液,则溶液中Fe2+的物质的量浓度是多少?_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
实验步驟如下:
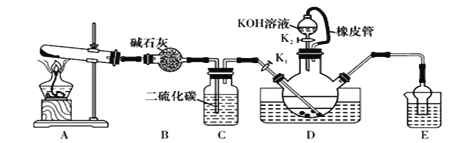
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
①实验前,应进行的操作是________________________。三颈烧瓶内盛放有一定量的CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____________________。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是______________________________,装置C的作用可能是_______________。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是____________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,__________________,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取20.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是________________。
②KSCN的质量分数为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组利用如图1装置进行乙醇的催化氧化实验并制取乙醛(试管丁中用水吸收产物),图中铁架台等装置已略去,实验时,先加热玻璃管中的镀银铜丝,约lmin后鼓入空气,请填写下列空白:

(1)检验乙醛的试剂是__;
A、银氨溶液 B、碳酸氢钠溶液 C、新制氢氧化铜 D、氧化铜
(2)乙醇发生催化氧化的化学反应方程式为____________;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是_____________,由于装置设计上的陷,实验进行时可能会____________;
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行,进一步研究表明,鼓气速度与反应体系的温度关系曲线如图2所示,试解释鼓气速度过快,反应体系温度反而下降的原因________,该实验中“鼓气速度”这一变量你认为__________________可用来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色,该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应,请你设计一个简单的实验,探究哪一种猜想正确______________________________?
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、砷同为VA族元素,它们的单质和化合物在生产、生活中有广泛应用。回答下列问题:
(1)下列有关氮原子电子排布图中,能量最低和最高的分别为____、___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)![]() 是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与
是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与![]() 互为等电子体的化合物分子是___(任写一种,填化学式)。
互为等电子体的化合物分子是___(任写一种,填化学式)。
(3)C、N、O是第二周期相邻的三种非金属元素,它们的第一电离能由大到小的顺序为____;NH3是一种极易溶于水的气体,其沸点比AsH3的沸点______(填“低”或“高”),其原因是______。
(4)砷是制造新型半导体的材料,同时砷的化合物又具有较强的毒性。
1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
(5)2018年7月《Science》报道,BingLv等通过反应:4BI3+As4![]() 4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
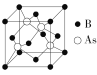
已知该晶胞参数为a pm,NA表示阿伏加德罗常数,则该晶胞的密度ρ=_____g·cm3(用代数式表示,可不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
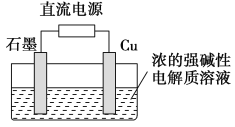
A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________。
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
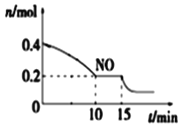
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.升温 B.增大CO浓度 C.加入催化剂 D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=_________________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分別在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O![]() CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
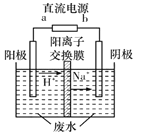
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分別为4OH--4e-=O2↑+2H2O、__________________。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分別注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______kg(计算结果保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】羟氨(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×10—9),其电离方程式为:NH2OH+H2O ![]() NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
NH3OH++OH-。在25℃时,用0.l0mol/L盐酸滴定20mL0.10mol/LNH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-lgc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5)
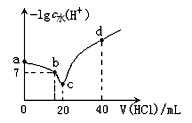
下列说法中错误的是
A.a点对应溶液的pH=9.5
B.c点溶液中存在离子反应: NH3OH++H2O ![]() NH2OH+H3O+
NH2OH+H3O+
C.d点溶液中:—lgc水(H+)=13
D.b点对应的溶液中有:c(NH3OH+)=c(Cl—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com