
科目: 来源: 题型:
【题目】(一)将AgCl溶于水形成饱和溶液
(1)写出沉淀溶解平衡方程式___________________________________, 写出AgCl的Ksp表达式________________________________________
(2)若向该饱和溶液中加入NaCl固体,则C(Ag+)_____(填“增大”或“减少”
(二)常温下,有浓度均为0.1molL-1的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)这4种溶液pH最小的是______(填序号);
(2)①中各离子浓度由大到小的顺序是_______________________;
(3)④的水解方程式为______________________________________;它的水解平衡常数经过计算为______;
(4)25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)和c(CN-)之比为____________,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
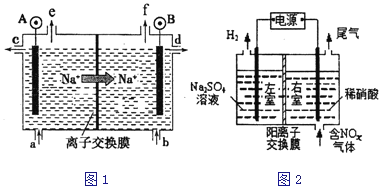
(1)电解食盐水是氯碱工业的基础.目前比较先进的方法是阳离子交换膜法,电解示意图如图1所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
①电解池实现了_______能向_______能的转化;
②图中A极要连接电源的__________(填“正”或“负”)极;
③电解总反应的化学方程式是______________________。
(2)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图2所示(图中电极均为石墨电极),若用NO2气体进行模拟电解法吸收实验,写出电解时NO2发生的电极反应_______________________。
(3)在实际生产中,可在铁件的表面上镀铜防止铁被腐蚀,装置示意图如下甲图:
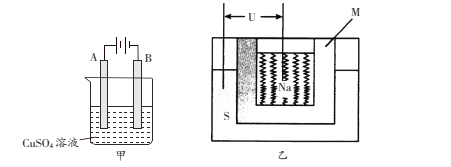
①电镀时,镀件与电源的____极连接,
②B电极上的电极反应是________________。
③乙图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx。用该电池作电源进行上述铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛是一种重要的化工原料,常用于生产脲醛树脂及酚醛树脂,在木材加工中的地位及其重要。
(1)工业中甲醛的制备方法常用以下几种。
①甲醇氧化法
CH3OH(g)=HCHO(g)+H2(g) △H = +84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H = -484kJ/mol
CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式是_______。
②天然气氧化法
在600-680℃下,使天然气(主要成分是CH4)和空气的混合物通过铁、钼等的氧化物催化剂,直接氧化生成甲醛。反应的化学方程式是_______。
(2)甲醛是污染室内环境的主要污染物,被称为室内污染“第一杀手”。
①去除甲醛有多种方法,其中,催化氧化法是一种比较高效的除甲醛方法。Na-Pt/TiO2催化剂催化氧化甲醛的反应机理如下图所示:
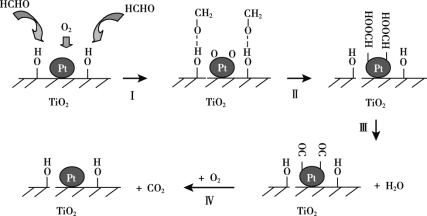
下列有关说法正确的是______(选填字母序号)。
a.该方法除去甲醛的化学方程式是:HCHO+O2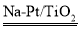 CO2+H2O
CO2+H2O
b.Na-Pt/TiO2催化剂能加快甲醛氧化速率,也能提高甲醛的转化率
c.反应过程中,HCHO只有部分化学键发生断裂
② 为测定居室中甲醛含量,将50L居室中气体缓缓通入25.00mL 0.01molL-1高锰酸钾酸性溶液中,使空气中的甲醛完全吸收,再用0.05molL-1H2C2O4溶液滴定,至终点时消耗H2C2O4溶液12.20mL 。
反应原理为:4MnO4—+12H++5HCHO=4Mn2++5CO2↑+11H2O
2MnO4— +6H++5H2C2O4=2Mn2++10CO2↑+8H2O
滴定终点的现象是_______。该室内空气中甲醛的含量是______mg/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列表格中信息填写
有机物A | 有机物B | 有机物C | 有机物D |
1.该物质的产量是衡量一个国家石油化工水平的标志 2.比例模型: | 1.该物质为天然气的主要成分 2.比例模型: | 1.该物质由碳,氢,氧三种元素组成 2.75%的该物质的水溶液可做医用消毒剂 | 1.分子式为C2H4O2 2.该物质的水溶液显酸性,是家庭常用调味剂 |
(1)有机物A的结构简式为_________________,它与溴水反应的化学方程式为___________________。
(2)有机物B的空间构型为_______________________将有机物B与氧气分别通入如图装置的两极组成燃料电池,该电池的负极反应为____________________________正极反应为_____________________________。
(3)有机物D在水溶液中的电离方程式为_______________________。 将pH=3的D溶液加水稀释10倍,所得溶液的pH_____4(填“大于”,“小于”),0.1molD与等量的NaOH溶液恰好完全反应的生成物显__________性(填“酸”或“碱”),该溶液中存在的电荷守恒关系式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、砷是原子序数依次增大的同一主族的三种元素,其化合物在工业农业中有重要用途。
(1)氮有多种重要的化合物。其中,N2O可用作发泡剂。
①NH3在加热和有催化剂的条件下,可以与O2反应生成N2O,该反应的化学方程式是_________。
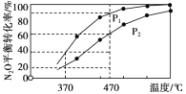
②在体积为1L的密闭容器中充入1mol N2O气体,发生反应2N2O(g) ![]() 2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
2N2(g)+O2(g)。在不同温度下N2O的平衡转化率如下图所示。该反应的△H_________0(填“>”、“<”或“=” ),P1_______P2(填“大于”、“小于”或“等于”),370℃时,该反应的平衡常数K=_________。
(2)PH3和NH3与卤化氢的反应相似,产物的结构与性质也相似,下列对PH3与HCl反应产物的推断正确的是_________(选填字母序号)。
a.能与NaOH溶液反应 b.含有离子键与非极性共价键 c.水溶液显酸性
(3)三价砷有剧毒,五价砷毒性减弱。含As2O3的污水可被次氯酸钠碱性溶液转化为AsO43-而降低毒性。该反应的离子方程式是_________。
(4)HNO3、H3PO4、H3AsO4的酸性由强到弱的关系是________,请用原子结构理论解释原因__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
查看答案和解析>>
科目: 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是
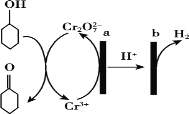
A.a极与电源负极相连
B.a极电极反应式是2Cr3++7H2O —6e-=Cr2O72-+14H+
C.b极发生氧化反应
D.理论上有1mol环己酮生成时,有2mol氢气放出
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
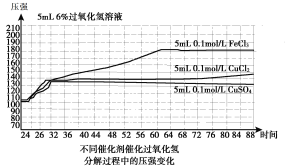
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响
查看答案和解析>>
科目: 来源: 题型:
【题目】对Na2C2O4溶液进行研究,下列说法不正确的是(室温下0.1mol· L—1H2C2O4的pH=1.3)
A.Na2C2O4溶液中离子关系:c(C2O42-)+ c(HC2O4-)+ c(H2C2O4) = c (Na+)
B.向Na2C2O4溶液中加入酚酞,溶液变红:C2O42-+H2O![]() HC2O4-+OH-
HC2O4-+OH-
C.向Na2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:2MnO4 -+ 5C2O42-+16 H += 2Mn 2+ +10CO2↑+8 H2O
D.向Na2C2O4溶液中加入足量稀硫酸制备草酸:C2O42-+2H+= H2 C2O4
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10mL 0.1 mol·L—1的HA溶液中逐滴滴入0.1 mol·L—1氨水,所得溶液pH及导电能力变化如图所示。下列分析不正确的是
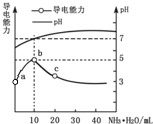
A.HA的电离方程式:HA![]() H+ +A—
H+ +A—
B.a点:c(H+)> c(A—)
C.b点:c(A—) 与c(NH4+)浓度大致相等
D.b~c点的溶液中,所含溶质均能促进水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com