
科目: 来源: 题型:
【题目】如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
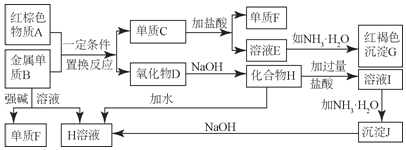
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
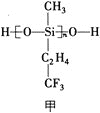
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。
(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
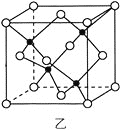
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了达到下列的实验要求,请从供选择的化学试剂或实验方法中选出合适的,将其编号填入对应的空格中,并按要求写出相应的方程式。
供选择的化学试剂或实验方法如下:
A.加入NaOH溶液,过滤、洗涤、干燥
![]() 通入适量的
通入适量的![]()
C.通入![]() 气体
气体
![]() 加入适量铁粉
加入适量铁粉
E.加入![]() 溶液,观察
溶液,观察
![]() 加入澄清石灰水,观察
加入澄清石灰水,观察
G.丁达尔效应
(1)鉴别![]() 胶体和
胶体和![]() 溶液:______;
溶液:______;
(2)除去镁粉中的少量铝粉杂质______;
(3)除去![]() 溶液中
溶液中![]() :______,离子方程式______;
:______,离子方程式______;
(4)实验室保存![]() 溶液时要加入______
溶液时要加入______![]()
(5)除去![]() 溶液中的少量
溶液中的少量![]() 杂质:______。
杂质:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下正戊烷(CH3CH2CH2CH2CH3)发生两种裂解反应:
Ⅰ.CH3CH2CH2 CH2CH3 (g)CH3CH===CH2(g)+CH3 CH3 (g) ΔH1=+274.2 kJ·mol-1
Ⅱ.CH3CH2CH2CH2CH3(g)CH3CH2CH3(g)+CH2===CH2(g) ΔH2=+122.7 kJ·mol -1
回答下列问题:
(1)在恒温恒压的密闭容器中,充入一定量的正戊烷发生裂解反应,起始时容器体积为 a L,一段时间反应达到平衡后容器体积变为 b L,此时正戊烷的转化率 α(正戊烷)=_________;向反应体系中充入一定量的水蒸气(水 蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将_____(填“增大”“减小”或“不变”),原因为_______________。
(2)温度为 T ℃时,往压强恒为 100 kPa 的密闭容器中充入 1 mol·L-1 CH3CH=CH2和 2 mol·L-1 CH3CH3发生反应:CH3CH===CH2(g)+CH3CH3(g) CH3CH2CH3(g)+CH2===CH2(g)ΔH3。测得 CH3CH2CH3 的物质的量浓度随时间 t 的变化如图中曲线Ⅰ所示。
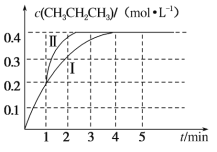
①ΔH3=_____。
②该反应的平衡常数 Kp=_____。(Kp 为以分压表示的平衡常数,分压=总压×物质的量分数,计算结果 保留 2 位小数)。
③若在 1 min 时,改变某一反应条件,曲线Ⅰ变为曲线Ⅱ,则改变的条件为_____。
(3)将 0.1 mol CH3CH3完全燃烧后的气体通入 100 mL 3 mol·L-1的 NaOH 溶液中,充分反应后所得溶液中离子浓度的大小顺序为_____。
(4)以稀硫酸为电解质溶液,CH3CH3 燃料电池的负极反应式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为 0.5 L 的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入 HCl 和 O2(如下表),加入催化剂发生反应 4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH,HCl 的平衡转化率(α)与 Z 和温度(T)的关系如图 所示。下列说法正确的是
容器 | 起始时 | ||
t/℃ | n(HCl)·mol-1 | Z | |
I | 300 | 0.25 | a |
II | 300 | 0.25 | b |
III | 300 | 0.25 | 4 |
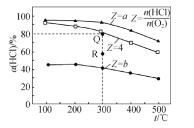
A.ΔH<0,b<4<a
B.300 ℃该反应的平衡常数的值为 64
C.容器Ⅲ某时刻处在 R 点,则 R 点的 v 正>v 逆,压强:p(R)>p(Q)
D.若起始时,在容器Ⅳ中充入 0.25 mol Cl2 和 0.25 mol H2O(g),300 ℃达平衡时容器中 c(HCl)=0.1 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu + Br2=CuBr2。下列说法正确的是( )
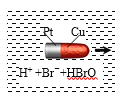
A.铜为电池的正极
B.铂不断溶解
C.电池工作时实现机械能向电能再向化学能转化
D.稀溴水为电解质溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】计算机芯片是一种用硅材料制成的薄片,其大小仅有手指甲的一半。一个芯片是由几百个微电路连接在一起的,体积很小,在芯片上布满了产生脉冲电流的微电路。计算机芯片利用这些微电流,就能够完成控制计算机、计算机自动化装置和其它各种设备所需要的操作。高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为:①![]() ②
②![]() ③
③![]() ;
;
![]() 的反应属于( )
的反应属于( )
A.置换反应B.化合反应C.分解反应D.复分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com