
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B.工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C.久置氯水pH变小
D.高压比常压有利于合成SO3的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】2-苯基丙烯是日化行业常用的化工原料,其合成路线如下(反应②、④的条件未写出)。
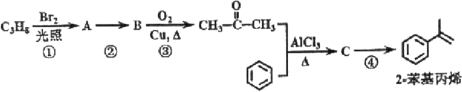
已知: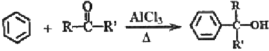
其中,R、R’为H原子或烷基。
(1)C3H8的结构简式为___;
(2)反应①的反应类型为___;
(3)反应②的化学反应方程式为___;
(4)反应③的反应类型为___;
(5)反应④的化学反应方程式为___;
(6)产物2-苯基丙烯在一定条件下可以发生加聚反应,加聚产物的结构简式为___;
(7)请以苯、乙醇及其他必要的无机试剂为原料,合成![]() 。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
。合成过程中,不得使用其他有机试剂。写出相关化学反应方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下。
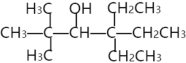
(1)根据课内所学知识,该醇可发生的反应包括:___(填字母序号)
A.与金属Na反应 B.与CuO反应
C.与浓盐酸反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47.6%)在90℃下充分反应,制备中间产物B。实验装置如图所示(夹持及加热仪器略去)。
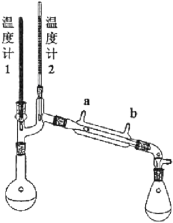
已知:①HBr溶液受热时,HBr能否蒸发受到体系汇总含水量的影响。具体情况如下表。
| <47.6% | 47.6% | >47.6% |
先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水按该比例一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47.6% |
②醇A、中间产物B的沸点均超过200℃。
(2)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___(填“温度计1”或“温度计2”)其水银球应___;
(3)实验时,冷凝水应从冷凝管的___(填“a口”或“b口”)流入。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6g醇A(0.1mol)、17.0g47.6%氢溴酸(含8.1gHBr、0.1mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39℃时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0g。经检测,该液体为纯净物,标记为产物C。取0.7gC在氧气中充分燃烧,共收集到2.2gCO2、0.9gH2O。另取少量C进行质谱试验,结果如图所示。
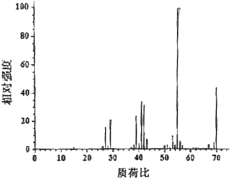
根据上述实验结果,C的分子式为___;
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1。综合上述实验结果,C的结构简式为___;
(6)反应结束后,圆底烧瓶内液体分为两层。可用___方法(填实验操作名称)将两液体分离;
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为10.7g。取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2。综合以上信息,本实验的实际总反应方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于工业合成氨反应N2+3H22NH3+Q(Q>0),下列判断正确的是( )
A.3体积![]() 和足量
和足量![]() 反应,必定生成2体积
反应,必定生成2体积![]()
B.使用合适的催化剂,可以提高提高原料的利用率
C.![]() 左右比室温更有利于向合成氨的方向进行
左右比室温更有利于向合成氨的方向进行
D.及时使氨液化、分离的主要目的是提高![]() 和
和![]() 的利用率
的利用率
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学用语的描述不正确的是( )
A. MgF2的电子式:![]()
B. 中子数为15的硅原子:![]()
C. 次氯酸的结构式:H—Cl—O
D. NH3·H2O的电离方程式:NH3·H2O![]() NH4++OH—
NH4++OH—
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
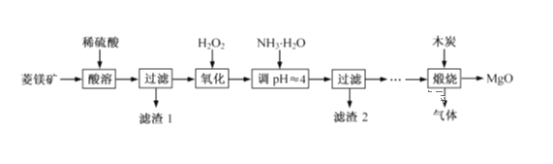
(1)MgCO3与稀硫酸反应的离子方程式为__________________________。
(2)加入H2O2氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式),过滤分离需要的玻璃仪器有 __________________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用图装置对煅烧产生的气体进行分步吸收或收集。
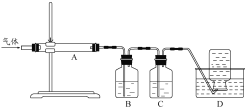
D中通过排水法收集的气体可以是___________(填化学式)。C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。
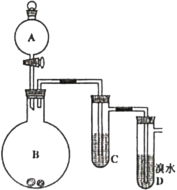
(1)实验室制备乙炔的方程式为___;
(2)仪器A的名称为___,为防止气体生成的速率过快,由A滴入B的试剂为___;
(3)装置C可选用的试剂为___(写出一种即可),其作用为___;
(4)反应开始后,D中的现象为___,所发生反应的反应类型为___;
(5)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
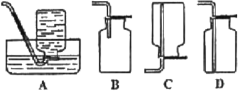
查看答案和解析>>
科目: 来源: 题型:
【题目】现代化学工业中,有机原料的主要来源为石油的裂化、裂解、重整产物、部分已经学习过的反应如下。
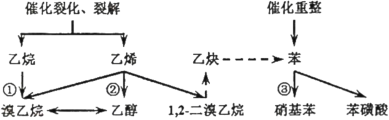
(1)请写出反应①由乙烷制备溴乙烷的化学反应方程式___;
(2)请写出反应②由乙烯制备乙醇的化学反应方程式___;
(3)请写出反应③由苯制备硝基苯的化学反应方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com