
科目: 来源: 题型:
【题目】某化合物的结构式(键线式)及球棍模型如下:

该有机物分子的核磁共振氢谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是( )

A.该有机物属于芳香化合物
B.键线式中的Et代表的基团为—CH3
C.该有机物不同化学环境的氢原子有8种
D.该有机物的分子式为C9H10O4
查看答案和解析>>
科目: 来源: 题型:
【题目】图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 的一溴代物都有4种
的一溴代物都有4种![]() 不考虑立体异构
不考虑立体异构![]()
B.CH3CH=CHCH3分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 的名称是2,3,
的名称是2,3,![]() 三甲基
三甲基![]() 乙基戊烷
乙基戊烷
D.木糖醇(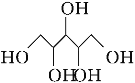 )和葡萄糖(
)和葡萄糖( )互为同系物,均属于糖类
)互为同系物,均属于糖类
查看答案和解析>>
科目: 来源: 题型:
【题目】尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:

下列说法错误的是( )
A.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
B.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3
C.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
D.1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
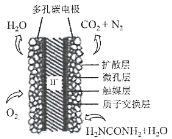
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1  图2
图2 
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com