
科目: 来源: 题型:
【题目】已知:CH3CH2CH2CH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);H=-2878kJ/mol
4CO2(g)+5H2O(l);H=-2878kJ/mol
(CH3)2CHCH3(g)+6.5O2(g)![]() 4CO2(g)+5H2O(l);H=-2869kJ/mol
4CO2(g)+5H2O(l);H=-2869kJ/mol
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目: 来源: 题型:
【题目】设水的电离平衡线如右图所示。

(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:Y<Z
B.化合物WY3中只存在离子键
C.原子半径:W>Z>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到
B.C6H3Cl2Br的同分异构体有7种(不含立体异构)
C.乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
D.X是苯的同系物,苯环上有两个位于对位的取代基,其结构可表示为![]() ,则X的结构共有(不考虑立体异构)10种
,则X的结构共有(不考虑立体异构)10种
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_______________。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是_________,上述离子浓度大小顺序关系中正确的是(选填序号)________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是__________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)___________c(Cl-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液c(OH-)均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点。如图所示为镁-次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
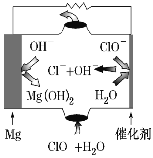
A.该燃料电池中镁为负极,发生氧化反应
B.正极反应为ClO-+H2O+2e-===Cl-+2OH-
C.电池总反应为Mg+ClO-+H2O===Mg(OH)2+Cl-
D.放电过程中OH-移向正极
查看答案和解析>>
科目: 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com