
科目: 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应2HI(g) ![]() H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率v(HI)=______________________。 该温度下,H2(g)+I2(g) ![]() 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_______,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是___________

A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可形成离子化合物Y2O和Y2O2。
(1)Y2Z的电子式是 ________
(2)实验室可用如图所示装置制备并收集XH3(缺少收集装置,夹持固定装置略去)。

①图中方框内应选用连接_____烧瓶收集XH3(填“A或B”)。
②实验室制法中大试管中的试剂一般选用(填写化学式)_________________。烧杯中溶液由无色变为红色,其原因是(用电离方程式表示):___________________________________
③XH3是工业上氧化法制硝酸的重要基础原料,制备过程中该物质发生的化学反应方程式为__________________________。
(3)磷在W2中燃烧可生成两种产物,其中一种产物甲,分子中各原子最外层不全是8电子结构,甲的化学式是_________。 XH3和HW两种化合物能反应生成离子化合物乙,n mol甲与n mol乙在一定条件下反应,生成4n mol HW和另一化合物,该化合物蒸气的密度是相同状况下氢气密度的174倍,其化学式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目: 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )

A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
(2)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)
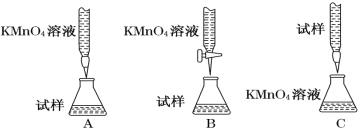
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需 (填仪器名称)。
在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a. 定容时,俯视容量瓶刻度线
b. 容量瓶在使用前内有少量蒸馏水
c. 转移溶液后的烧杯、玻璃棒未洗涤
d. 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
a.浓盐酸 b.稀硫酸 c.稀硝酸 d.浓硫酸
方案二 称量法:操作流程如下:

(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式______ __。
步骤②中除用H2O2外还可以使用的物质是
步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是

A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
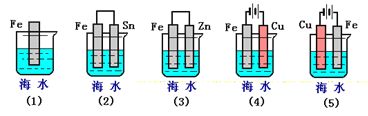
A. (5)(2)(1)(3)(4) B. (2)(5)(3)(4)(1)
C. (5)(3)(4)(1)(2) D. (1)(5)(3)(4)(2)
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空:
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(2)近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

Pt(a)电极是电池的________极,电极反应式为________________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为_________________________
(3)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

①A是铅蓄电池的________极,铅蓄电池正极反应式为_____________________,
②Ag电极的电极反应式是__________________________,
③Cu电极的电极反应式是________________________________,
CuSO4溶液的浓度________(填“减小”“增大”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A、KNO3盐桥中的K+移向Cu(NO3)2溶液
B、Cu作负极,发生还原反应
C、电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D、工作一段时间后,AgNO3溶液中c(Ag+)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值.下列有关叙述正确的是
为阿伏伽德罗常数的值.下列有关叙述正确的是![]()
A.硝酸与铜反应得到![]() 、
、![]() 共23g,则铜失去的电子数为
共23g,则铜失去的电子数为![]()
B.10g![]() 的乙醇水溶液中所含氢原子数目为
的乙醇水溶液中所含氢原子数目为![]()
C.标准状况下![]() 的平均相对分子质量为
的平均相对分子质量为![]() 的
的![]() 与
与![]() 含有中子数
含有中子数![]()
D.1molCu与足量的S完全反应,转移电子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com