
科目: 来源: 题型:
【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):
H3PO4(浓)+NaBr![]() NaH2PO4+HBr、CH3CH2OH+HBr
NaH2PO4+HBr、CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
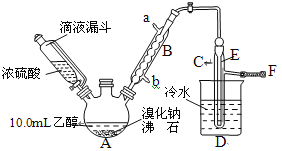
有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度g/mL | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是___。
(2)仪器B的名称为___,B中进水口为___(填“a”或“b”)口。
(3)实验中用滴液漏斗代替分液漏斗的优点为:___。
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?___(用化学方程式表示)。
(5)将C中的馏出液转入三角烧瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
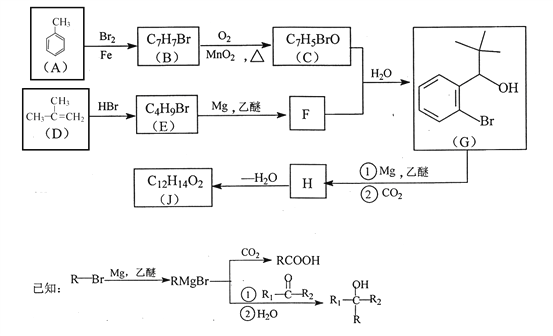
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
科目: 来源: 题型:
【题目】国际气候变化经济学报告中显示,大气中CO2浓度每增加一倍,可使地表平均温度上升56℃。为减少温室效应的加剧,需将工业生产中产生的CO2分离出来加以利用。回答下列问题:
(1)在500℃时,Li4SiO4与低浓度的CO2反应生成两种锂盐,待该反应达到化学反应的限度后,升温至700℃,两种锂盐反应放出高浓度的CO2,而Li4SiO4可循环利用。写出700℃时两种锂盐反应的化学方程式___。
(2)CO2与NH3反应可合成化肥。
①已知:2NH3(g)+CO2(g)=NH2COONH4(s) △H=-159.5kJmol-1
NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJmol-1
H2O(l)=H2O(g) △H=+44.0kJmo1-1
则CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l)的△H=___kJmol-1
②将足量CO2通入饱和氨水中可制得碳铵(NH4HCO3)。已知室温下Kb(NH3H2O)=1.8×10-5,Ka1(H2CO3)=4.3×10-7,则0.0.1molL-1NH4HCO3溶液室温下呈___ (填“酸性”、“中性”或“碱性”)。
(3)在一定条件下,CO2与H2可用于合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比[![]() ]达平衡时CO2的转化率[α(CO2)]如图1所示。
]达平衡时CO2的转化率[α(CO2)]如图1所示。
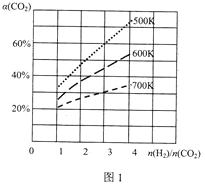
该反应的△H___0(填“>”、“=”或“<”)。
②500K、投料比[![]() ]=3时,H2的平衡转化率为___;设总压强为P0,则化学平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
]=3时,H2的平衡转化率为___;设总压强为P0,则化学平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③直接甲醇燃料电池(DMFC)具备低温快速启动、燃料洁净环保以及电池结构简单等特性。该电池使用合适的合金为电极,以氢氧化钠溶液、甲醇、空气为原料。写出其负极电极反应式___。
(4)在TiO2/Cu2Al2O4为催化剂时,CO2和CH4可反应生成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图2所示。300℃400℃时,影响乙酸生成速率的主要因素是___(填“温度”或“催化剂”)。
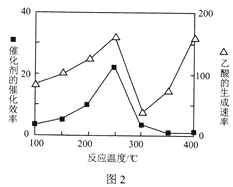
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示三种物质均是从巴旦杏中提取出的有香味的有机物,下列说法正确的是
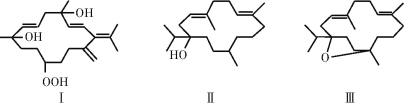
A.Ⅰ、Ⅱ、Ⅲ互为同分异构体
B.Ⅰ、Ⅱ、Ⅲ均可使酸性高锰酸钾溶液褪色
C.Ⅱ、Ⅲ分别与H2反应,均最多可以消耗2 mol H2
D.Ⅰ、Ⅱ、Ⅲ中只有Ⅲ是苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是( )
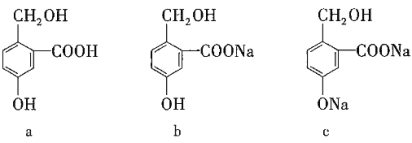
选项 | a转化为b | a转化为c | c转化为b |
A | NaOH | Na | CO2 |
B | Na2CO3 | NaOH | HCl |
C | NaHCO3 | NaOH | CO2 |
D | NaHCO3 | NaCl | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2与人们的日常生活、生产和科学研究密不可分,综合利用CO2是解决能源问题的有效途径之一。回答下列问题:
(1)用CaSO4代替O2与燃料CO反应,能得到较纯的CO2,有关反应如下:
①CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) ΔH1=-189.2kJmol-1(主反应)
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5kJmol-1(副反应)
③CO(g)=![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2kJmol-1(副反应)
CO2(g) ΔH3=-86.2kJmol-1(副反应)
则反应2CaSO4(s)+7CO(g)=CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=___。
(2)已知CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH。向一密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)=0.2molL-1,c(H2)=0.8molL-1,c(H2O)=1.6molL-1。若200℃时该反应的平衡常数K=64.8,则该反应的ΔH___(填“>”或“<”)0。
(3)一定条件下,CO2还可以转化为低碳烯烃,反应的化学方程式为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH,在两个容积均为2L的恒容密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率α(CO2)与温度的关系如图所示。
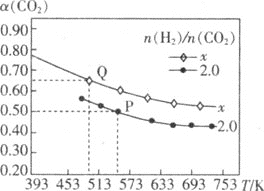
①x___(填“>”“<”或“=”)2.0。
②若起始加入的CO2、H2的物质的量分别为1mol和2mol,则P点时的平衡常数K=___。
③比较P点和Q点的化学平衡常数:Kp___(填“>”“<”或“=”)KQ,理由是___。
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图所示。

①a极发生___(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)以CO2与NH3为原料合成尿素[CO(NH2)2]的技术已十分成熟。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.47 kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+28.49kJmol-1
③H2O(g)=H2O(l) △H=-88.0kJmol-1
则NH3和CO2合成尿素和气态水的热化学方程式为___。
(2)已知:工业上在120℃条件下利用NH3和CO2合成尿素。在恒温恒容条件下,下列能说明合成尿素反应达平衡的是___
A.NH3和CO2的比例保持不变
B.混合气体的压强不再发生变化
C.2v(NH3)(正)=v(CO2)(逆)
D.混合气体的密度不再改变
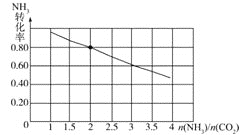
(3)氨碳比[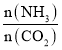 ]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[
]对合成尿素有重要影响。恒温恒容条件下,在一个2L的密闭容器中将总物质的量为nmol的NH3和CO2以不同的氨碳比进行反应,NH3的转化率变化如图所示;当[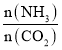 ]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
]=2时,平衡吋测得尿素的物质的量为1mol,则n=___。此温度下该反应的化学平衡常数K=___。
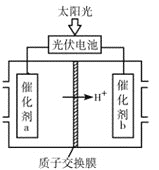
(4)研究人员设计出一种新型太阳能电池,能直接把CO2和H2O转化为CO、H2和O2,原理如图所示,该装置中能量转化方式为___,催化剂b表面的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中现象及得出的结论正确的是( )
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色褪去,试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | 有机物X中一定是醛 |
C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
D |
| 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×10-3;Ka2=6.3×10-8;Ka3=4.2×10-13 | Ka=6.6×10-4 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为___。
(2)已知:Ⅰ.CaO(s)+H2SO4(l)CaSO4(s)+H2O(l) ΔH=-271kJmol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJmol-1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为___。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___(填“增大”“减小”或“不变”,下同);HF的平衡浓度___。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5molCO和1molH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02molL-1min-1。则CO的平衡转化率α=___;该反应的平衡常数K=___。
②在压强不变的密闭容器中发生上述反应,设起始的(![]() )=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。
)=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com