
科目: 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g)![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是( )

A. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
B. 图一t2时改变的条件可能是升高了温度或增大了压强
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ 。(已知:完全沉淀后离子浓度低于1×l0-5) mol/L)
④“滤渣2”的主要化学成分为 _______。
⑤“沉锂”过程中加入的沉淀剂为饱和的 __________(化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“ ___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________。
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6![]() LixC6+Li1-xCoO2其工作原理如图2。
LixC6+Li1-xCoO2其工作原理如图2。
下列关于该电池的说法正确的是___________(填字母)。
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目: 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是__________。

A.混合气体的颜色变浅,量筒中液面上升
B.量筒内壁上出现的油状液滴,应是三氯甲烷、四氯甲烷的混合物
C.水槽中有白色固体物质析出
D.甲烷与氯气反应后的产物只有CCl4
Ⅱ.根据烯烃的性质回答下列问题。
(1)一瓶无色气体,可能含有CH4和CH2=CH2或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?___________。
②上述实验可能涉及的反应类型有_____。
(2)含有 的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
的化合物与CH2=CH2一样,在一定条件下可聚合成高分子化合物。
①广泛用作农用薄膜的聚氯乙烯塑料,是由 聚合而成的,其化学方程式是___________________。
聚合而成的,其化学方程式是___________________。
②电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________(写结构简式)聚合而成的。
),它是由________(写结构简式)聚合而成的。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
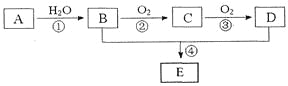
请回答下列问题:
(1)B、D分子中的官能团名称分别是__________、__________。
(2)写出下列反应的化学方程式,并注明反应类型:
②____________________,___________;④____________________,___________。
(3)在实验室利用B和D制备E的实验中,若用1mol B和1 mol D充分反应,能否生成1mol E_________,原因是__________。
(4)若184g B和120g D反应能生成106g E,则该反应的产率______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一个2 L的恒容密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
A. 平衡时,v(A)∶v(B)∶v(C)∶v(D) =4∶3∶2∶1
B. 混合气的平均相对分子质量可作为平衡标志
C. 充入惰性气体使压强增大可加快反应速率
D. C的平均反应速率为0.5 mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加固体碳的量 ②保持压强不变,充入Ar使体系体积增大
②将容器压缩体积 ④保持体积不变,充入Ar使体系压强增大
A. ①③B. ①④C. ①②D. ③④
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了以Ni / Al2O3 为催化剂,由CO2和H2转化为产品CH4的反应历程,其示意图如下:

下列说法不正确的是
A. 总反应方程式为:CO2+4H2![]() CH4+2H2O
CH4+2H2O
B. 催化剂可有效提高反应物的平衡转化率
C. 在反应历程中,H―H键与C=O键断裂吸收能量
D. 反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
查看答案和解析>>
科目: 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
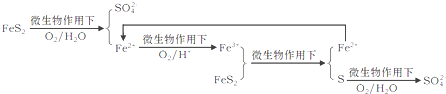
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目: 来源: 题型:
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是________________________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是___________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com