
科目: 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、![]() 、H3AsO4、H2O和一种未知物质X。
、H3AsO4、H2O和一种未知物质X。
(1)已知![]() 在反应中得到电子,则该反应的还原剂是______________。
在反应中得到电子,则该反应的还原剂是______________。
(2)已知0.2mol![]() 在反应中得到1mol电子生成X,则X的化学式为_____________。
在反应中得到1mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知_________。
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
c.还原性:![]() d.还原性:
d.还原性:![]()
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目: ___________。
___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图能量关系示意图,下列说法正确的是
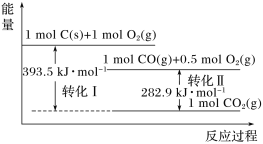
A. 1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g)= 2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学-物质结构与性质)
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成![]() 键和
键和![]() 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述![]() 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述![]() 键 。
键 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。
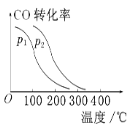
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞 (如图1)。
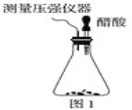
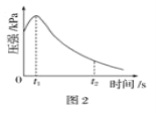
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了____________腐蚀,此时,碳粉表面发生的电极反应式是____________。
(2)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是______。
A.太阳光催化分解水制氢气比电解水制氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH溶液为介质的氢氧燃料电池的总反应式相同
(3)电动车采用了一种高效耐用的新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极电极反应式为_________;
②充电时阳极电极反应式为_______。
(4)下列描述中,符合生产实际的是(______)
A. 电解食盐水制得金属钠 B. 电解熔融氯化铝制取金属铝,用石墨作阳极
C. 一氧化碳高温还原铁矿石制得铁 D.电解熔融氧化镁制取金属镁,用铁作阳极
(5)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)(______)
A.阴极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)①CaCO3(s)=CaO(s) + CO2(g) ΔH = + 177.7 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示不正确的有__(填序号)。
(b)根据上述信息,写出C转化为CO的热化学方程式__________。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为__kJ·mol-1。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为__(用阿伏加德罗常数NA表示),放出的热量为__kJ。
(4)下列有关中和热的说法正确的是(________)
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
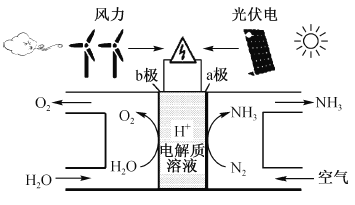
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目: 来源: 题型:
【题目】新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)![]() Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
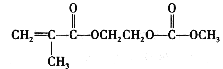
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是____________________________________。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有________、________、________(填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为____________________________________。
(4)写出M与足量氢氧化钠溶液反应的化学方程式:____________________________________。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4溶液,当 2 mol电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 CuSO4溶液,当加入1 mol Cu(OH)2恢复电解前浓度时,电路中转移了4mol e-
C.将Mg、Al金属放在NaOH溶液中组成原电池,Mg做负极,Al做正极
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com