
科目: 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2,t3,t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2,t3,t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
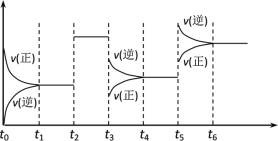
A.t2升高温度B.t3时降低了温度
C.t5时增大了压强D.t5~t6时间内转化率最低
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸钠![]() 是有机合成的常用还原剂,一般制备方法是将黄磷
是有机合成的常用还原剂,一般制备方法是将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() 。
。![]() 是一种无色、有毒的可燃性气体。实验装置如图所示:
是一种无色、有毒的可燃性气体。实验装置如图所示:
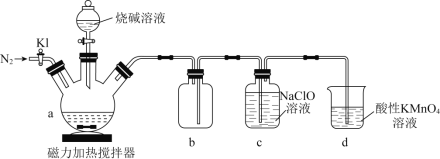
回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开![]() ,通入
,通入![]() 一段时间,关闭
一段时间,关闭![]() ,打开磁力加热搅拌器,滴加烧碱溶液。
,打开磁力加热搅拌器,滴加烧碱溶液。
①活性炭粉末作为黄磷的分散剂,原理是_______;b的作用______________。
②![]() 中反应的化学方程式为_______________________________。
中反应的化学方程式为_______________________________。
(2)反应结束后,打开![]() ,继续通入
,继续通入![]() ,目的是______________________________。d的作用是__________________。
,目的是______________________________。d的作用是__________________。
(3)![]() 中生成
中生成![]() 和NaCl,相关物质溶解度
和NaCl,相关物质溶解度![]() 如下:
如下:
|
| |
NaCl | 37 | 39 |
| 100 | 667 |
充分反应后,将c中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为_____________,然后________________、______________、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(4)产品纯度测定:
取产品m克配成![]() 溶液,取25mL于锥形瓶中,酸化后加入
溶液,取25mL于锥形瓶中,酸化后加入![]() 碘水,于暗处充分反应后,以淀粉溶液做指示剂,用
碘水,于暗处充分反应后,以淀粉溶液做指示剂,用![]() 溶液滴定至终点,平均消耗VmL。相关反应方程式为:
溶液滴定至终点,平均消耗VmL。相关反应方程式为:![]() ,
,![]() 。产品纯度表达式为________________。
。产品纯度表达式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则:
①混合溶液中由水电离出的c(H+)________(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)-c(M+)=________ mol·L-1;c(H+)-c(MOH)=________ mol·L-1。
(2)有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:①在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色,②B的钠盐溶液的pH值小于C的钠盐溶液pH值,③A酸与D的盐反应生成A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为 ________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)等体积等物质的量浓度的盐酸和氨水溶液混合后,溶液呈_____(填“酸性”,“中性”或“碱性”),溶液中c(H+)_____ c(OH—)+c(NH3·H2O)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=__________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
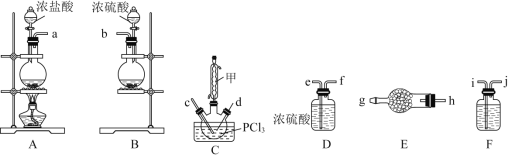
【题目】某兴趣小组在实验室模拟反应PCl3+SO2+Cl2![]() POCl3+SOCl2制备重要的化工原料
POCl3+SOCl2制备重要的化工原料![]() 。
。
已知:![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水极易水解,易与
,遇水极易水解,易与![]() 反应;
反应;
![]() 熔点
熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,能溶于
,遇水强烈水解,能溶于![]() 。
。
(1)装置A中发生反应的离子方程式是________。
(2)以上各仪器接口的连接顺序是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ,装置E、F中所装的试剂分别是________、________。
,装置E、F中所装的试剂分别是________、________。
(3)装置C制备![]()
①仪器甲的作用是________________________________;
②反应温度控制在![]() ,其原因是________________________________;
,其原因是________________________________;
③SOCl2发生水解反应的化学方程式是________________________________。
(4)产品含杂质![]() ,通过佛尔哈德法可测定
,通过佛尔哈德法可测定![]() 的含量:称取
的含量:称取![]() 样品在碘量瓶中完全水解,将水解液配制成100mL,取
样品在碘量瓶中完全水解,将水解液配制成100mL,取![]() 于锥形瓶中,加入
于锥形瓶中,加入![]() 的
的![]() 溶液
溶液![]() ,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入
,再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入![]() 指示剂,用
指示剂,用![]() 溶液滴定过量的
溶液滴定过量的![]() 至终点,做平行实验,平均消耗KSCN溶液
至终点,做平行实验,平均消耗KSCN溶液![]() 。
。![]() 已知:
已知:![]() ,
,![]()
①将水解液配成100mL,需用的玻璃仪器除了玻璃棒、烧杯外,还有________;
②若无硝基苯覆盖沉淀表面,测定溶液中![]() 的物质的量将________
的物质的量将________![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]() ;
;
③POCl3的物质的量分数为________。
![]() 已知:
已知:![]() ,
,![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】现有![]() 、
、![]() 两种溶液,选择填空:
两种溶液,选择填空:
A. ![]()
(1)当它们pH相同时,其物质的量浓度______.
(2)当它们的物质的量浓度相同时,其pH的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______.
(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(6)将pH相同的两种酸均稀释10倍后,pH关系为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化磷可用作农药中间体、催化剂和磷的溶剂等,沸点为![]() ,易水解、易被氧化。某学习小组设计如下实验制备
,易水解、易被氧化。某学习小组设计如下实验制备![]() 并测定其纯度。请回答下列问题:
并测定其纯度。请回答下列问题:
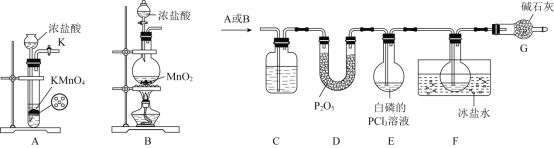
(1)制备![]() 的实验装置应选择装置________
的实验装置应选择装置________![]() 填“A”或“B”
填“A”或“B”![]() ,不选择另一装置的理由是________.
,不选择另一装置的理由是________.
(2)选择合理的![]() 制备装置组装成完整的实验装置。
制备装置组装成完整的实验装置。
①装置C中试剂的名称为________。
②实验时,检查装置的气密性、加入相应试剂后,向装置中通入![]() ,当观察到_____
,当观察到_____![]() 填实验现象
填实验现象![]() 时,用热水浴加热装置E。
时,用热水浴加热装置E。
③装置G的作用为________。
(3)制得的![]() 中混有少量
中混有少量![]() ,二者均能水解生成两种酸。该小组同学测定
,二者均能水解生成两种酸。该小组同学测定![]() 纯度的实验步骤如下:
纯度的实验步骤如下:
![]() 取
取![]() 样品于洁净试管中,加入适量水,充分反应后,通入热的水蒸气,用
样品于洁净试管中,加入适量水,充分反应后,通入热的水蒸气,用![]() 的NaOH溶液吸收蒸出的气体;
的NaOH溶液吸收蒸出的气体;
![]() 待吸收液冷却至室温后,配制成
待吸收液冷却至室温后,配制成![]() 溶液;
溶液;
![]() 取所得溶液
取所得溶液![]() ,以酚酞溶液为指示剂,用
,以酚酞溶液为指示剂,用![]() 的盐酸标准溶液滴定至终点时,消耗标准溶液的体积为
的盐酸标准溶液滴定至终点时,消耗标准溶液的体积为![]() 。
。
①步骤i中![]() 发生水解反应的化学方程式为________。
发生水解反应的化学方程式为________。
②滴定至终点时的实验现象为________.
③该样品中![]() 的质量分数为________
的质量分数为________![]() 计算结果精确到
计算结果精确到![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】一、(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因_______________。
(2)稀Na2S溶液有一种腐卵气味,加入AlCl3溶液后,腐卵气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________。
二、依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:①称量绿矾样品,配成100 mL待测溶液,②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸,③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处,④滴定待测液至滴定终点时,滴定管的液面读数b mL,⑤重复滴定2~3次。
(1)如何知道滴定到达终点?__________。下列操作会导致测定结果偏低的是_______。
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有____________;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
查看答案和解析>>
科目: 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
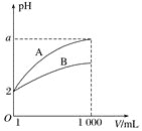
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液的酸性强
C.a=5时,A是强酸,B是弱酸
D.一定有关系:5>a>2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com