
科目: 来源: 题型:
【题目】25℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随加水体积变化的曲线如图所示。下列说法正确的是
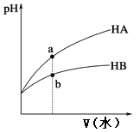
A. HB的酸性强于HA
B. a点溶液的导电性大于b点溶液
C. 同浓度的NaA与NaB溶液中,c(A-)=c(B-)
D. 加水稀释到pH相同时,酸HA、HB用到的水V(A)小于V(B)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
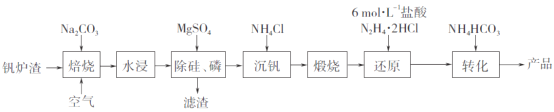
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是( )
A.H2Y的电离方程式为:H2Y![]() 2H++Y2-
2H++Y2-
B.HY-的水解方程式为:HY-+H2O![]() H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-)
D.该酸式盐溶液中离子浓度关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
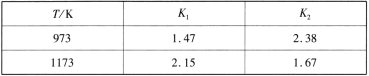
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
图1 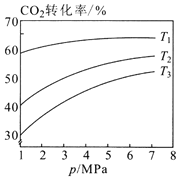 图2
图2 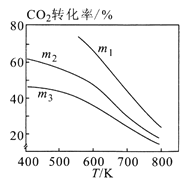 图3
图3 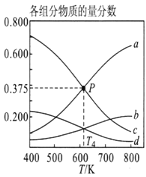
①图1中投料比相同,温度从高到低的顺序为________。
②图2中m1、m2、m3从大到小的顺序为________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为__________。
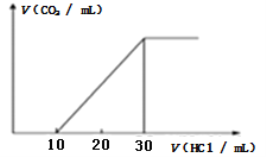
(3)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
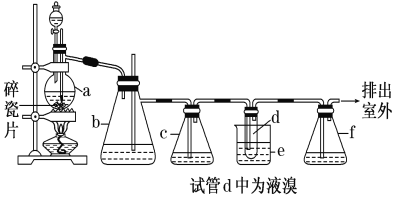
有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是________。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e), 但不用冰水进行过度冷却,原因__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
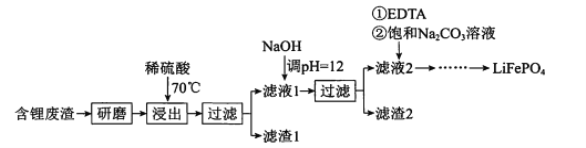
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)

ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
ⅲ某些物质溶解度(S):
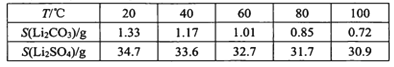
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是 ___。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是 ______。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是 ____g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
II.纯化Li2CO3粗品
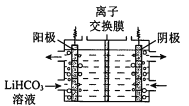
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是 _______。
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】可降解高分子材料P的结构为: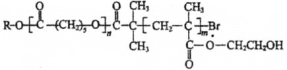 。如图是P的合成路线。
。如图是P的合成路线。
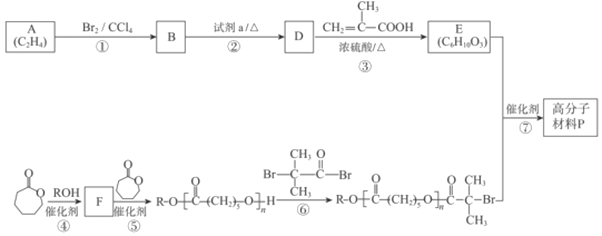
已知:![]() +R3OH
+R3OH![]() +R2OH。
+R2OH。
(1)B的结构简式是_______,试剂a是_______。
(2)③的化学方程式是______。
(3)G与E互为同分异构体,符合下列要求的G共有______种。(不考虑立体异构)①含有和E(C6H10O3)相同的含氧官能团②分子中含有六元环状内酯结构
(4)当④中反应物以物质的量之比1:1发生反应时,反应⑤的化学方程式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)命名下列有机物:HOCH2CH2CHO_____,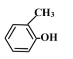 ________。
________。
(2)燃烧某有机物A 1.50 g,生成1.12 L(标准状况)CO2和0.05 mol H2O,该有机物的蒸气对空气的相对密度是1.04,则该有机物的分子式为_____。
(3)已知端炔烃在催化剂存在下可发生偶联反应:2RC≡CH![]() RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
已知: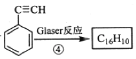 ,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com