
科目: 来源: 题型:
【题目】(I)常温下,回答下列问题:(提示:lg2 = 0.3)
(1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________;
(2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________;
(3)将pH=11的氨水稀释100倍后pH范围为___________________________________;
(4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。
(II)反应A(s)+2B(g)2C(g)在密闭容器中达到平衡。
(1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。
(2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。
(3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。
(4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤脱硫可减少SO2的排放,燃煤脱硫技术受到各界科研人员的关注。某种燃煤脱硫技术的原理为CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=-394.0 kJ·mol-1。保持其他条件不变,平衡时CO2的体积分数随起始CO物质的量的变化关系如图所示:
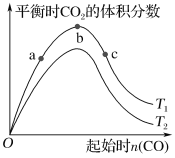
下列有关说法正确的是( )
A.T1>T2
B.T1时,b点对应状态的SO2转化率最高
C.T1时,b点后曲线下降是因为CO质量分数升高
D.减小压强可提高CO、SO2转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+![]() O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
②C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
④C4H10(g)+![]() O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-1 746kJ·mol-1B.ΔH=-2 658 kJ·mol-1
C.ΔH=-2 878 kJ·mol-1D.ΔH=-1 526 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】测定Cu(NO3)2nH2O的结晶水含量,下列方案中肯定不可行的是( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量Cu(NO3)2
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目: 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
![]()
下列判断无法确定的是
A.PAFC因水解而能净水B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性D.乙溶液呈酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是________反应 (填“放热”或“吸热”);
(2)下列条件的改变能加快其反应速率的是_______(选填序号);
①升高温度;②保持体积不变,只增加CO的质量;③保持体积不变,充入Ne使体系压强增大;④保持压强不变,充入Ne使容器的体积增大
(3)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2,发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如下图所示:
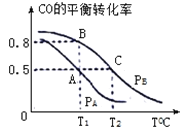
①A、B两点对应的压强大小关系是PA________PB;(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ____________;
③在P1压强、T1℃时,该反应的平衡常数K=___________;
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ____ v逆(填 >、< 或 =)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
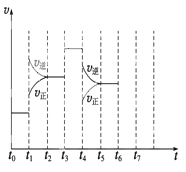
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
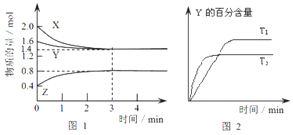
(1)容器中发生的反应可表示为_________________________;
(2)反应进行的前3min内,用X表示的反应速率v(X)=_____________;
(3)保持其他条件不变,升高温度,该反应的化学平衡将________方向移动;(填“正反应”或“逆反应”)
(4)①若X为有色气体,T℃ 时反应达平衡后,将反应容器的容积减少一半,则达到新的平衡后,容器内气体的颜色较原平衡时________;(填“变深、变浅或不变”)
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是_________(填字母代号);
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
(5)在体积为2L的密闭容器中,充入2mol X和1mol Y进行反应,2min后反应达到平衡,此时平衡混合物中X为0.4mol/L,则Y的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com