
科目: 来源: 题型:
【题目】光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g) +CO(g)![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
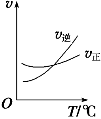
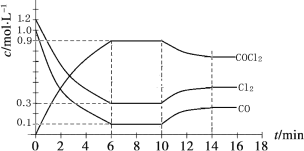
A.0~6 min内,反应的平均速率v(Cl2)=0.15 mol ·L-1·min -1;
B.若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动;
C. 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) >T(15)。
D.若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)市场上出售的“热敷袋”是利用原电池原理产生热量,主要成分是铁屑、碳粉和少量的NaCl、水等。“热敷袋”在启用前用塑料袋使之与空气隔绝;启用时打开塑料袋轻轻揉搓,就会放出热量,使用后,会发现袋内有许多铁锈生成。请回答:
①碳粉的作用是___________________,加入NaCl的作用是________________________。
②正极反应的方程式为______________________________________。
③写出使用后生成铁锈所发生的氧化还原反应的化学方程式______________________________________________________________________。
(2)一种既能供电又能固氮的新型氢氮燃料电池的工作原理如图所示:其中电解液为溶有化合物A的稀盐酸。回答下列问题:
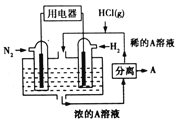
①电子从通入______(填“N2”或“H2”)的电极流出,化合物A为_________(填化学式)
②正极的电极方程式为________________________________。
③电路中通过2.4mol电子时,两极共消耗标准状况下的气体___________L。
④放电过程中电解质溶液的PH会_______(填“增大”或“减小””或“不变”),为维持电解质PH基本不变,可往溶液中通入________气体(填“NH3”或“HCl”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
)与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
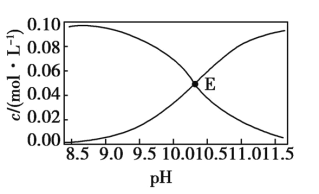
A.图中E点溶液表示浓度均为0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,c(![]() )与c(
)与c(![]() )之和保持不变
)之和保持不变
查看答案和解析>>
科目: 来源: 题型:
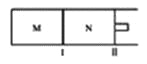
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中各种微粒浓度大小关系或结论正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: ![]()
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(H+)=2c(OH-)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是

A. 碳[C(s)]的燃烧热△H为 -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的热量
C. 反应2Cu2O(s)+O2(g)=4CuO(s)的活化能为292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= +35.6kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
科目: 来源: 题型:
【题目】拆开1 mol共价键所吸收的能量或形成1 mol共价键所释放的能量称为键能。已知:H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,N2 (g)+ 3H2(g) ![]() 2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
A.H—H比N≡N更牢固
B.N≡N键能约为945.6 kJ/mol
C.合成氨反应选择适当的催化剂是为了提高H2的转化率
D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com