
科目: 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如图。下列说法不正确的是

A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点④所示溶液中:c(Na+)>c(CH3COO-) >c(OH-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
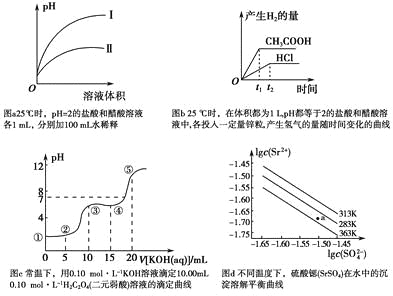
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )

A. 电池工作时,正极附近的pH降低
B. 当消耗1 mol O2时,有2 mol Na+由甲槽向乙槽迁移
C. 负极反应为4OH-+N2H4-4e-===N2↑+4H2O
D. 若去掉阳离子交换膜,电池也能正常工作
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
![]() ;
;![]() ①
①
![]() ;
;![]() ②
②
①下列说法正确的是 ______。
A.![]()
B.当反应①中![]() 时,表明该反应达平衡状态
时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度![]() 不考虑热量损失
不考虑热量损失![]() ,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应![]() 当甲烷的转化率为
当甲烷的转化率为![]() 时,此时平衡常数为 ______。
时,此时平衡常数为 ______。
(2)蓝液是由![]() 、
、![]() 及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的
及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的![]() :
:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
以及第三步生成四氧化三铁,请补充第三步反应的方程式并配平: ______。
①为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: ______。
②将固体草酸锰![]() 放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示
放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示![]() 质量单位为
质量单位为![]() :则
:则![]() 时,剩余固体的成分为 ______(填化学式);在
时,剩余固体的成分为 ______(填化学式);在![]() ,剩余固体的成分为 ______(填化学式)。
,剩余固体的成分为 ______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铬及其化合物具有广泛应用。请回答下列问题:
(1)![]() 与
与![]() 的化学性质相似。向
的化学性质相似。向![]() 溶液中加入过量NaOH溶液,反应的离子方程式为______;加热
溶液中加入过量NaOH溶液,反应的离子方程式为______;加热![]() 溶液,灼烧固体,所得固体的成分是______。
溶液,灼烧固体,所得固体的成分是______。
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示。
的变化如图所示。
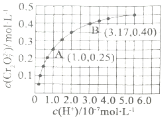
①下列可判断反应达平衡状态的是______![]() 填标号
填标号![]() 。
。
A.溶液的pH不再变化
B.![]()
C.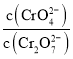 为定值
为定值
②A点![]() 点的逆反应速率大小为
点的逆反应速率大小为![]() 逆
逆![]() ______
______![]() 逆
逆![]() 填:“
填:“![]() ”、“=”或“
”、“=”或“![]() ”
”![]() 。
。
③由图得出,溶液酸性增强,![]() 的平衡转化率______
的平衡转化率______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;![]() 时,该反应的平衡常数为______。
时,该反应的平衡常数为______。
(3)化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______
生成砖红色沉淀,指示到达滴定终点。硝酸银标准液应盛放在______![]() 填:“酸式”、“碱式”
填:“酸式”、“碱式”![]() 滴定管中。
滴定管中。
(4)常温下,铬酸![]() ,
,![]() ,
,![]() 溶液中离子浓度由大到小的顺序为______。
溶液中离子浓度由大到小的顺序为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将诺贝尔化学奖授予古迪纳夫等三位科学家,表彰他们在锂离子电池方面的研究成果,钴酸锂电池是他们的研究成果之一,其工作原理为LixC6+Li1-xCoO2![]() C6+LiCoO2。下列说法正确的是
C6+LiCoO2。下列说法正确的是
A.放电时Li+从正极通过导线流向负极
B.放电时负极的电极反应式为:LixC6-xe-=C6+xLi+
C.充电时电池的负极与电源的正极相连
D.充电时阴极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目: 来源: 题型:
【题目】回答问题:
Ⅰ.常温下,CaS的Ksp=10-8,饱和溶液中存在平衡: CaS(s)![]() Ca2+(aq)+S2-(aq)
Ca2+(aq)+S2-(aq)
(1)①该温度下,将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合,能否产生沉淀?答___;温度升高时,Ksp__(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)___,原因是___(用文字和离子方程式说明)。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___。
Ⅱ.(已知Ksp[Fe(OH)3]=10-38)若0.01mol/L FeCl3溶液中,如果要生成Fe(OH)3沉淀,应调整溶液pH,使pH___,若要使其沉淀完全,pH应___。(提示:填数据时,要有>,<,=)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气是一种更优良的燃料,但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:______。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为______,热化学方程式如反应①所示,此外反应②③也可以获取![]() 。
。
①太阳光催化分解水制氢:![]()
![]()
②焦炭与水反应制氢:![]()
![]()
③甲烷与水反应制氢:![]()
则反应![]() 的
的![]() ______。
______。
(3)在恒温恒容的密闭容器中,某储氢反应:![]() 达到化学平衡。下列有关叙述正确的是______。
达到化学平衡。下列有关叙述正确的是______。
![]() 若向答器内再加入少量
若向答器内再加入少量![]() ,则
,则![]() 转化率增大
转化率增大
![]() 使用催化剂可以加快反应速率,提高生产效率
使用催化剂可以加快反应速率,提高生产效率
![]() 吸收
吸收![]() 只需
只需![]()
![]() 容器内气体压强保持不变
容器内气体压强保持不变
(4)氢气可与氧气直接化合制备过氧化氢,是一种具有环保意义的直接、简便和经济的合成过氧化氢的方法;其工艺特点主要采用水作反应介质,活性炭为载体的![]() 催化剂,还有适当的助剂。合成时在反应物中加入稀释剂。如
催化剂,还有适当的助剂。合成时在反应物中加入稀释剂。如![]() 、
、![]() 或Ar,请说出需要加入稀释剂的原因______;另外在此法合成过氧化氢的过程中容易发生一些副反应导致产率的降低,请写出一个副反应的化学方程式______。
或Ar,请说出需要加入稀释剂的原因______;另外在此法合成过氧化氢的过程中容易发生一些副反应导致产率的降低,请写出一个副反应的化学方程式______。
(5)长征五号系列运载火箭,又称:“大火箭”、“冰箭”,是我国研制的一次性大型低温液体运载火箭,火箭使用了以液氢为燃烧剂,被氧为氧化剂的高能推进剂。已知:
①![]()
②![]()
③有关过程如图:
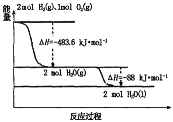
请写出火箭液氢燃烧的热化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1mol/L NaOH溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图。下列说法错误的是:

A.点①所示溶液中:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点①②③所示溶液中,均成立:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.点③表示整个滴定过程恰好达到滴定终点,在过程中溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向100mL 1molL﹣1H2SO3溶液中逐渐滴入1molL﹣1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=﹣lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
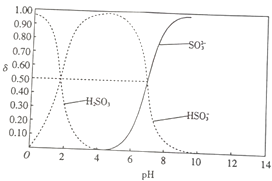
A.pH=1.85时,c(H2SO3)=c(HSO3﹣)
B.pH=6时,c(Na+)>c(HSO3﹣)>c(SO32﹣)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO3﹣)+2c(SO3﹣)+c(OH﹣)
D.加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com