
科目: 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将![]() 缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人
缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加人![]() 溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )
溶液,整个过程中pH的变化如图所示,下列有关叙述正确的是( )

A.曲线③④段有离子反应:![]()
B.可依据②处数据计算所溶解的![]()
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处![]() 约为
约为![]() 处
处![]() 的两倍
的两倍
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
A.平均相对分子质量增大 B.NO2的转化率提高
C.压强为原来的2倍 D.颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下图,下列说法不正确的是
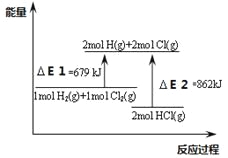
A.△E2是2mol HCl(g)的总键能
B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1
C.通常情况下H2与Cl2混和不会反应
D.该反应是一个吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。

③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是

A. 燃烧时化学能全部转化为热能
B. 断开1mol氧氢键吸收930kJ能量
C. 相同条件下,1mol氢原子的能量为E1,1mol氢分子的能量为E2,则2E1<E2
D. 该反应生成1mol水蒸气时能量变化为245kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2%H2O2溶液 | 无 |
② | 10mL5%H2O2溶液 | 无 |
③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是__。

(3)加入0.1gMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率变化的原因是__。

查看答案和解析>>
科目: 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是

A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
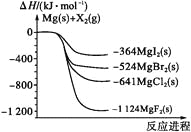
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com