
科目: 来源: 题型:
【题目】在一定条件下,向密闭容器中加入一定量的C(s)与H2O(g)发生可逆反应C(s) + H2O(g)![]() CO(g) + H2(g),反应达到平衡后C(s)与H2O(g)转化率为2:1关系,则下列说法正确的是
CO(g) + H2(g),反应达到平衡后C(s)与H2O(g)转化率为2:1关系,则下列说法正确的是
A.开始加入的C(s)与H2O(g)物质的量为2:1
B.若增大压强,H2O(g)转化率不变化
C.达到平衡后混合气体平均式量可能为16
D.开始反应后混合气体平均式量一直减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应mA(g)+nB(g)![]() pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是( )
A.化学计量数:m+n<pB.平衡向正反应方向移动了
C.物质B的转化率减小了D.物质C的质量分数增加了
查看答案和解析>>
科目: 来源: 题型:
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
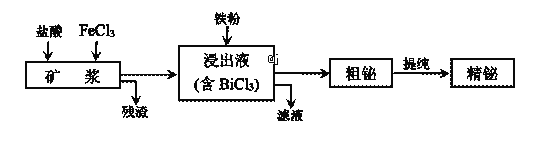
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl-。
BiOCl+2H++2Cl-。
(1)矿浆浸出时加入盐酸的作用是______________。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为________________。
(3)残渣中含有一种单质,该单质是_______________。
(4)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以___________(填化学式)进入残渣中。
(5)粗铋提纯时,阴极的电极反应式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下反应N2O4(g)![]() 2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是
①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应速率减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深 ⑤升高温度,正反应速率减小,平衡逆向移动
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中发生如下反应![]() ,达平衡后,温度一定时,将气体体积缩小到原来的
,达平衡后,温度一定时,将气体体积缩小到原来的![]() ,当达新平衡时,C的浓度为原来的
,当达新平衡时,C的浓度为原来的![]() 倍,则下列推断正确的是
倍,则下列推断正确的是![]()
A.平衡向正向移动了
B.![]()
C.达新平衡时,A的浓度小于原平衡A浓度的2倍
D.达新平衡时,容器内总压一定比原平衡的2倍小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O=HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体B.水C.CaCO3固体D.NaOH固体
查看答案和解析>>
科目: 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质 B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已在H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是________kJ。
②CH3OH(l)不完全燃烧生成一氧化碳和液态水的热化学方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面有关化学反应速率和限度的图象和实验结论表达均正确的是![]()
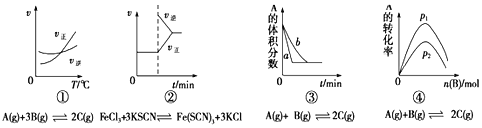
A.图①是其他条件一定时反应速率随温度变化的图象,图象表明该反应的![]()
B.图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.图③可能是压强对化学平衡的影响
D.图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。 利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
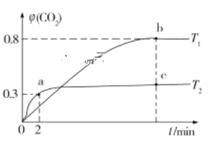
(1)温度为T2时,0~2 min 内,CO2的平均反应速率υ(CO2)=__________________。
(2)b点时CO的转化率为__________,化学反应的平衡常数K=_______(填表达式)。
(3)反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
(4)上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左”“向右”或“不”)移动。
(5)下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化
B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化
D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com