
科目: 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5mol/(L·min)B.v(D)=1mol/(L·min)
C.v(C)=0.8mol/(L·min)D.v(B)=0.3mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】11、浓度均为 ![]() 的
的![]() 和
和 ![]() ,在一定条件下发生反应
,在一定条件下发生反应![]()
![]()
![]() ,测得
,测得![]() 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

A.平衡时CO与![]() 的物质的量比为
的物质的量比为![]()
B.![]() 由大到小的顺序为
由大到小的顺序为 ![]()
C.![]() , p
, p![]() 条件下,该反应
条件下,该反应![]() 时达到平衡点X,则
时达到平衡点X,则 ![]()
D.随着温度升高,该反应的平衡常数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述正确的是( )
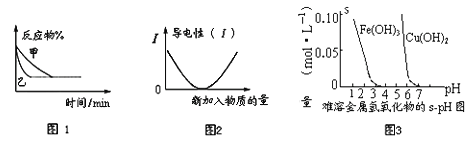
A. 图1可能表示压强对可逆反应A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B. 图2可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
C. 据图3,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH到4左右
D. 当反应COCl2(g) ![]() CO(g) + Cl2(g) △H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率
CO(g) + Cl2(g) △H>0,达到平衡时①升温②减压③加催化剂都能提高COCl2转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列图像的描述正确的是
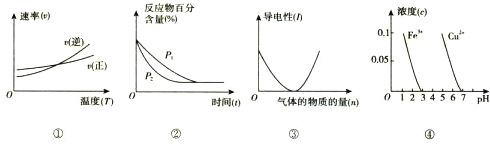
A. 根据图①判断反应A2(g)+3B2(g) ![]() 2AB3(g)的 △H>0
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释 ④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥石灰石高温分解⑦铝热反应⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O=CO+H2 ⑩Al与盐酸反应
A. ②③④⑥⑦⑧⑨ B. ②④⑥⑧⑨ C. ①②④⑥⑧ D. ②③④⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】如图图示与对应的叙述相符的是![]()
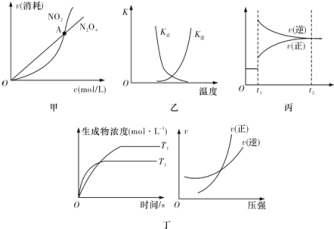
A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应![]() ,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应![]() ,正、逆反应的平衡常数K随温度的变化
,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应![]() 在
在![]() 时刻增大压强
时刻增大压强
D.图丁表示反应![]() :
:![]() ;
;![]() ;
;![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________。
(3)氯化铁水解的离子方程式为__________ ,配制氯化铁溶液时滴加少量盐酸的作用是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 与稀盐酸反应生成
与稀盐酸反应生成![]() 的量与反应时间的关系如图所示。下列结论中不正确的是
的量与反应时间的关系如图所示。下列结论中不正确的是![]()
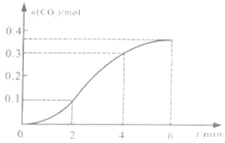
A.反应在![]() min内生成
min内生成![]() 的平均反应速率为
的平均反应速率为![]()
![]()
B.反应开始4min内,温度变化比浓度变化对反应速率的影响更大
C.4min后,反应速率减小的主要原因是![]() 减小
减小
D.图中反应在![]() 内的平均反应速率最小
内的平均反应速率最小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
① 称量1.000 g样品溶于水,配成250 mL溶液;
② 准确量取25.00 mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用0.1000 mol/L 的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)用_______滴定管(填“酸式”或“碱式”)盛装0.1000 mol/L的盐酸标准液。
(2)判断滴定终点到达时的现象_________。
(3)该滴定过程的滴定曲线是下列的______(选填“a”、“b”)。
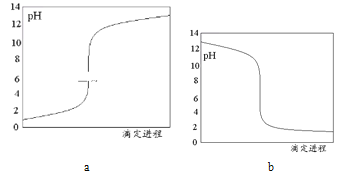
(4)若出现下列情况,测定结果偏高的是__________。
a 滴定前用蒸馏水冲洗锥形瓶
b 在振荡锥形瓶时不慎将瓶内溶液溅出
c 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
(5)通过计算可知该烧碱样品的纯度为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com