
科目: 来源: 题型:
【题目】常温下,取![]() HY溶液与
HY溶液与![]()
![]() NaOH溶液等体积混合
NaOH溶液等体积混合![]() 忽略溶液体积的变化
忽略溶液体积的变化![]() ,测得混合溶液的
,测得混合溶液的![]() ,则下列说法正确的是
,则下列说法正确的是![]()
A.混合溶液中由水电离出的![]()
B.溶液中离子浓度由大到小的顺序为![]()
C.![]()
![]()
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应
①![]()
②稀溶液中,![]() ,
,
下列结论正确的是![]()
A.碳的燃烧热为![]()
B.![]() 的能量比
的能量比![]() 的能量高221kJ
的能量高221kJ
C.![]() 浓
浓![]() 与1molNaOH溶液混合,产生
与1molNaOH溶液混合,产生![]() 热量
热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出![]() 热量
热量
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是![]()
A.在测定中和热的实验中,至少需要测定并记录的温度是3次
B.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
C.一定条件下,某可逆反应的![]() ,则正反应活化能大于
,则正反应活化能大于![]()
D.已知![]()
![]() ,则碳的燃烧热为
,则碳的燃烧热为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】华为集团在通信网络、IT、智能终端和云服务等领域为客户提供有竞争力、安全可信赖的产品、解决方案与服务,与生态伙伴开放合作,持续为客户创造价值,释放个人潜能,丰富家庭生活,激发组织创新。华为坚持围绕客户需求持续创新,加大基础研究投入,厚积薄发,推动世界进步。其中MATE30手机采用锂离子电池,其正极材料为磷酸亚铁锂(LiFePO4),它具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_______(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性(类似于氯化铝),蒸汽状态下以双聚分子存在的FeCl3的结构式为____,其中Fe的配位数为____。
(3)苯胺(![]() )的晶体类型是_____。苯胺与甲苯(
)的晶体类型是_____。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______。
(4)NH4H2PO4中,电负性最高的元素是______;其中PO43-采用_______杂化。
(5)如下图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。该物质的化学式可表示为_____;若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-10Cm),则该晶体的密度为__g·cm-3。
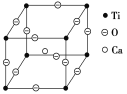
查看答案和解析>>
科目: 来源: 题型:
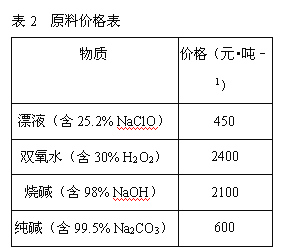
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。
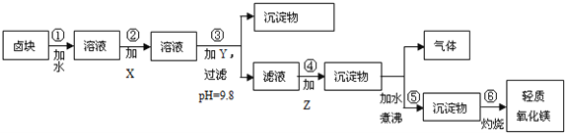
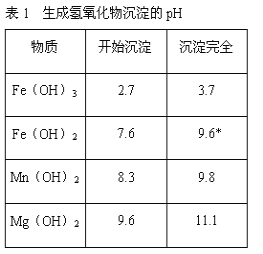
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。
(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com