
科目: 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol·L-1,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)该反应的平衡常数表达式为________,若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变 c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)氯碱厂电解饱和食盐水制取烧碱,若利用下图装置制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
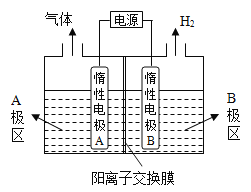
①B极区电解液为_____________溶液(填化学式),A极要连接电源的______________(填“正”或“负”)极。
②阳极电极反应式为_____________________________,电解过程中Na+向_____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
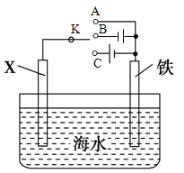
①若X为碳电极,为减缓铁的腐蚀,开关K应置于_____________处(填“A”、“B”或“C”)。
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
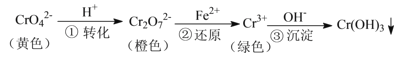
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
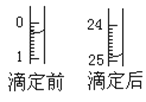
(1)用___式滴定管盛装cmol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是___。如图表示某次滴定时50mL滴定管中前后液面的位置。滴定管读数时应注意___。用去的标准盐酸的体积是___mL。
(2)该实验应选用__(填“酚酞”或者“石蕊”)作指示剂;操作中如何确定终点?__。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果___;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___;
C,读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果___。
查看答案和解析>>
科目: 来源: 题型:
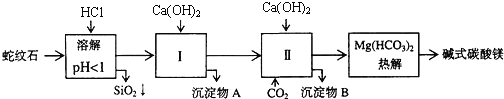
【题目】蛇纹石矿可以看做是由MgO、![]() 、
、![]() 、
、![]() 组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
氢氧化物 |
|
|
|
开始沉淀pH |
|
|
|
(1)蛇纹石矿加盐酸溶解后,溶液里除了![]() 外,还含有的金属离子是 ______
外,还含有的金属离子是 ______
(2)进行Ⅰ操作时,控制溶液![]() 有关氢氧化物沉淀的pH见上表
有关氢氧化物沉淀的pH见上表![]() 不能过量,若
不能过量,若![]() 过量可能会导致 ______ 溶解、 ______ 沉淀生成.
过量可能会导致 ______ 溶解、 ______ 沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入 ______ ![]() 填入物质的化学式
填入物质的化学式![]() ,然后 ______
,然后 ______ ![]() 依次填写实验操作名称
依次填写实验操作名称![]() .
.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是 ______ ![]() 填写物质化学式
填写物质化学式![]() .
.
(5)若热分解不完全,所得碱式碳酸镁中将混有![]() ,则产品中镁的质量分数 ______
,则产品中镁的质量分数 ______ ![]() 填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于
填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于![]() .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式___。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=___。
(3)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为:___;
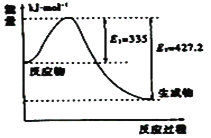
②若起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=___kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧锂离子电池的正极材料试样![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通过下列实验方法回收钴、锂.
可通过下列实验方法回收钴、锂.
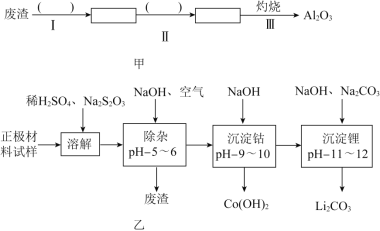
(1)在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的离子方程式为 ______ .
在溶解过程中反应的离子方程式为 ______ .
沉淀物 | 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除杂时通入空气的目的 ______ ,所得的废渣成分为 ______ ![]() 从废渣中获得
从废渣中获得![]() 的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
(3)工业上,将![]() 粗品制备成高纯
粗品制备成高纯![]() 的部分工艺如图乙.
的部分工艺如图乙.
![]() 将
将![]() 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
![]() 电解后向LiOH溶液中加入过量
电解后向LiOH溶液中加入过量![]() 溶液,过滤、烘干得高纯
溶液,过滤、烘干得高纯![]() .
.
①![]() 中,阴极的电极反应式是 ______ .
中,阴极的电极反应式是 ______ .
②![]() 中,生成
中,生成![]() 反应的化学方程式是 ______ .
反应的化学方程式是 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 铝土矿
铝土矿![]() 主要成分为
主要成分为![]() ,还含有
,还含有![]() 、
、![]() 是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如图:
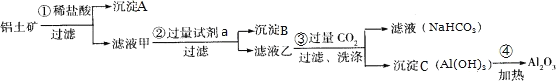
①沉淀A成分是______;步骤![]() 中的试剂a是______;
中的试剂a是______;![]() 以上均填化学式
以上均填化学式![]() ;
;
②简述检验所得滤液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量铁的氧化铜制取氯化铜晶体
用含少量铁的氧化铜制取氯化铜晶体![]() 。有如下操作:
。有如下操作:
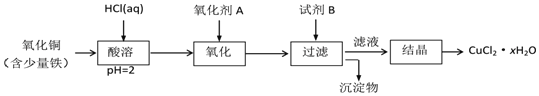
已知:在pH为![]() 时,
时,![]() 几乎完全转化为
几乎完全转化为![]() 沉淀,
沉淀,![]() 却不反应。
却不反应。
①氧化剂A可选用______ ![]() 填编号,下同
填编号,下同![]() ;
;
A.![]()
![]()
![]()
![]() 浓盐酸
浓盐酸
②试剂B可选用______;
A.NaOH ![]()
![]()
![]()
③试剂B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去过量的氧化剂
除去过量的氧化剂
④从滤液经过结晶得到氯化铜晶体的方法是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com