
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车排放的尾气是大气污染气体之一。如何减少污染气体的排放是科学家研究的热门课题。请回答下列问题:
(1)已知:CO的燃烧热为283.0kJ·mol1,N2(g)+2O2(g) =2NO2(g) ΔH=+64kJ·mol1,则NO2(g)+2CO(g)=![]() N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
N2(g)+2CO2(g) ΔH=___kJ·mol1,若反应中有14g还原剂发生反应,则转移电子___mol。
(2)使汽车排放的CO和NO在一定条件下发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
N2(g)+2CO2(g),可有效地减少空气污染。若在一定温度下,将6molNO、8molCO充入10L固定容积的容器中发生上述反应,反应过程中各物质的浓度变化如图1所示。
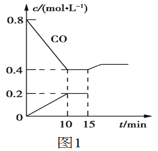
①该反应的化学平衡常数K=___。NO的平衡转化率=___。
②15min时,若改变反应条件,导致CO浓度发生如图1所示的变化,则改变的条件可能是___。
a.缩小容器体积b.增加CO2的量c.体积不变通入少量氩气d.加入催化剂
③当NO与CO的起始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图2所示,则下列说法正确的是___。
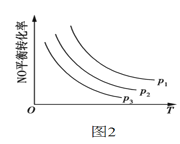
A.该反应ΔH<0 B.p1<p2<p3
C.升高温度正反应速率减小,逆反应速率增大 D.温度不变,增大压强,平衡常数增大
④以下说法中能判断反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)达到平衡的是___。
N2(g)+2CO2(g)达到平衡的是___。
A.反应物和生成物的物质的量相等 B.单位时间内消耗1molNO同时生成1molCO2
C.混合气体压强不再发生变化 D.NO的浓度不再变化
⑤向反应容器中再分别充入下列气体,能使NO转化率增大的是___。
A.O2 B.N2 C.CO D.NO
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象能得出相应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中 | 气体红棕色加深 | 2NO2(g) |
C | 某黄色溶液X中加入淀粉-KI溶液 | 溶液变成蓝色 | 溶液X中含有Br2 |
D | 无水乙醇中加入浓硫酸,加热,产生的气体Y通入酸性KMnO4溶液 | 溶液紫色褪去 | 气体Y中含有乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度
B.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
C.2C+SiO2![]() Si+2CO↑,此反应能够进行是因为碳的还原性比硅强
Si+2CO↑,此反应能够进行是因为碳的还原性比硅强
D.弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

(1)三种乙醇燃料电池中正极反应物均为_________________。(填化学式)
(2)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动。
(3)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。

请回答下列问题。
(1)该电池属于_________电池(填“一次”或“二次”)。
(2)负极是_________,电极反应式是__________________________。
(3)使用时,正极区的pH_________(填“增大”、“减小”或“不变”)。
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____。(填字母)
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2CO(g)+O2(g)=2CO2(1) △H<0
(5)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关水溶液的一些叙述正确的是( )
A.某水溶液中,c(H+)=![]() mol/L,该溶液呈中性
mol/L,该溶液呈中性
B.已知电离常数H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11,HClO的Ka=2.95×10-8,相同温度相同浓度溶液的pH:Na2CO3<NaClO
C.常温下,向Na2S溶液中加入NaCl溶液,S2-的水解程度不受影响
D.向含有Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,先产生黄色沉淀,说明c(I-)最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com