
科目: 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | N(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() molL-1min
molL-1min
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是( )
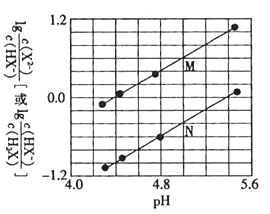
A.Ka1(H2X)的数量级为![]()
B.曲线N表示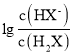 与pH的变化关系
与pH的变化关系
C.NaHX溶液中:c(H+)<c(OH-)
D.当混合物呈中性时,c(Na+)>c(X2-)>c(HX-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,测得溶液的pH随加入盐酸的体积变化如图所示。下列说法正确的是( )
A.①溶液中:c(Cl-)=2c(NH4+)+2c(NH3·H2O)
B.②溶液中:c(NH4+)= c(Cl-)= c(OH-)= c(H+)
C.③溶液中:c(H+)= c(OH-)+ c(NH4+)+c(NH3·H2O)
D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
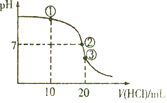
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )
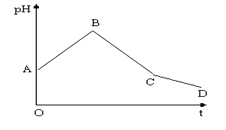
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目: 来源: 题型:
【题目】将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

A. 水的电离程度:b>c>a
B. 若分别用等浓度的NaOH溶液完全中和,消耗NaOH的体积:b>a>c
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:a>b>c
D. 溶液中离子总浓度: a>b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
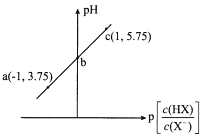
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目: 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为![]() 。下列判断不正确的是
。下列判断不正确的是

A.闭合K时,d电极的反应式为![]()
B.当电路中转移![]() 电子时,Ⅰ中消耗的
电子时,Ⅰ中消耗的![]() 为
为![]()
C.闭合K时,Ⅱ中![]() 向c电极迁移
向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组模拟工业上回收分银渣中的银,过程如下:
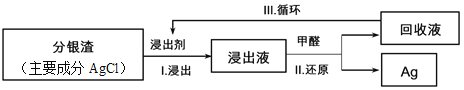
(1)Na2SO3溶液和氨水均可作浸出剂,但由于氨水易______(填物理性质),故用Na2SO3溶液更环保。
(2)Ⅰ中主要反应:AgCl + 2![]()
![]()
![]() + Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
+ Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。
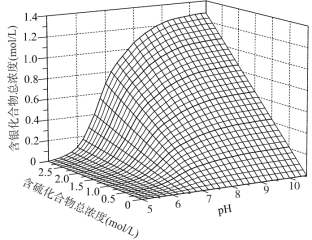
①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是______。
②解释①中变化趋势的原因:______。
③pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是___。
(4)将Ⅱ中反应的离子方程式补充完整:
□__![]() +□___OH- +□______ = □______ +□______ +□______ + CO32-
+□___OH- +□______ = □______ +□______ +□______ + CO32-
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】40 ℃时,在氨—水体系中不断通入![]() ,各种离子的变化趋势如图所示。下列说法不正确的是( )
,各种离子的变化趋势如图所示。下列说法不正确的是( )
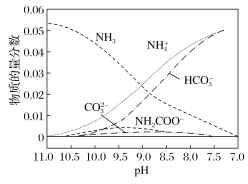
A.在![]() 时,
时,![]()
B.不同pH的溶液中存在关系:![]()
C.随着![]() 的通入,
的通入,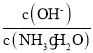 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含![]() 的中间产物生成
的中间产物生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com