
科目: 来源: 题型:
【题目】下列关于水的电离平衡的相关说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,Kw增大,pH增大,呈碱性
C.向水中加入少量硫酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,Kw减小
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中正确的是
A.溶液中:c(H+)=c(OH-)+c(SO42-)
B.NaHSO4属于酸式盐,加入水中促进水的电离
C.1 mol NaHSO4晶体中含有的离子总数为3NA
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】我国规定饮用水质量标准必须符合下表所示要求:
项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
相关值 | 6.5~8.5 | <0.0045mol·L-1 | <100个·mL-1 |
下图是源水处理成自来水的工艺流程示意图。
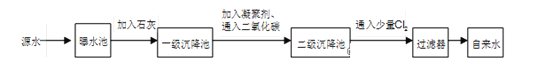
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,在一级沉降池中所得沉淀的主要成分为 _____ 和_______ (化学式)。
(2)FeSO4·7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀。凝聚剂除去悬浮固体颗粒的过程______________(填写编号)。
①只是物理过程; ②只是化学过程; ③是物理和化学过程。
(3)Cl2的作用是______ ,这种作用是基于Cl2和水反应的产物具有 _______ 性。
查看答案和解析>>
科目: 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系如图所示:NH3←N2→NO→NO2→HNO3
回答下列问题:
(1)N元素在元素周期表中的位置为第___周期,第___族;画出N原子结构示意图___。
(2)工业上用氮气和氢气合成氨气,请写出NH3的电子式___。
(3)实验室可以利用氢氧化钙固体和氯化铵固体制备氨气,请写出该反应的化学反应方程式___;并写出实验室检验氨气的具体操作___。
(4)NO是治疗心血管疾病的信使分子,NO与空气接触的反应现象是___,写出该反应的化学方程式___,若该反应转移0.4mole-,则消耗的NO分子数是___(用NA表示阿伏伽德罗常数)。
(5)浓硝酸具有不稳定性,实验室应该将浓硝酸保存在带玻璃塞的___(填“无色”或“棕色”)试剂瓶中。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各表述与示意图不一致的是
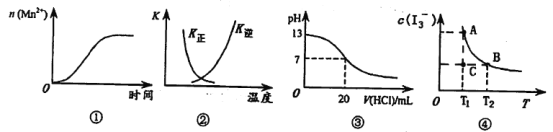
A.图①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】减少汽车尾气造成环境污染的方法之一是在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧和SO2的转化。
(1)写出CO与NO反应的化学方程式:________________。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)=1.3×10-5 mol·L-1。若在5mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液。下列叙述中不正确的是
A.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,以酚酞溶液作指示剂,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如图:
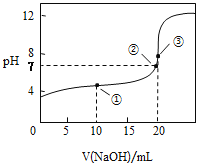
(1)在整个实验过程中,不需要的仪器或用品是___(填序号)。
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)到达滴定终点的标志是___。
(3)下列操作会导致测定结果偏高的是___。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(4)如图点①所示溶液中c(CH3COO-)+c(OH-)___c(CH3COOH)+c(H+)(填“>”“<”或“=”,下同),点②所示溶液中:c(Na+)___c(CH3COOH)+c(CH3COO-)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,有下列五种溶液:A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液A呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(2)溶液E呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(3)比较溶液A、C中c(NH4+)的大小关系是A___C(填“>”、“<”或“=”)。
(4)常温下,测得溶液B的pH=![]() ,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2X2(g)+Y2(g)![]() 2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
2Z(g) ΔH1=-akJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和lmolY2,在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
(1)此反应平衡常数表达式为___;若将温度降低到300℃,则反应平衡常数将___(填增大、减少或不变)。
(2)能说明反应己达平衡状态的是___
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
(3)若将上述容器改为恒压容器![]() 反应器开始体积相同
反应器开始体积相同![]() ,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将____(填变大、变小或不变)。
,相同温度下起始加入2molX2和lmolY2达到平衡后,Y2的转化率将____(填变大、变小或不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com