
科目: 来源: 题型:
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
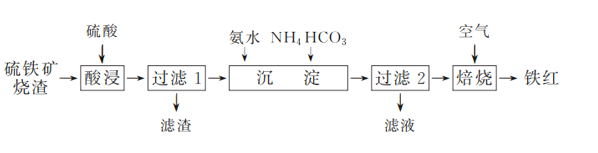
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________。
(3) “过滤1”所得滤液中含有的阳离子有________。
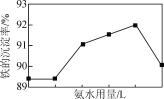
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________(填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】几种中学化学常见的单质及其化合物相互转化的关系图如下:
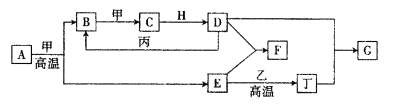
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物
②A由X和Y两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为___________,每反应lmol的A转移的电子数为_____________mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:______________________;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
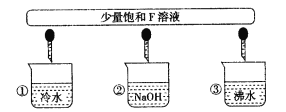
试将①、②、③对应的分散质具体的化学式填人下列方框中:________________
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:________________
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)与氮同一主族,As原子比N原子多两个电子层。可以形成As2S3、As2O5、H3AsO3、H3AsO4,等化合物,有着广泛的用途。回答下列问题:
(1)As的原子序数为______________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式____________。该反应需要在加压下进行,原因是___________。
(3)己知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)
H2(g)+2O2(g)=H3AsO4(s) ![]()
H2(g)+![]() O2(g)=H2O(l)
O2(g)=H2O(l) ![]()
2As(s)+![]() O2(g)=As2O5(s)
O2(g)=As2O5(s) ![]()
则反应As2O5(s)+3 H2O(l)=2 H3AsO4(s)的![]() =______________________。
=______________________。
(4)298K肘,将2OmL 3xmol·L-1 Na3AsO3、20m L3xmol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是_____(填标号)。
a.v(I-)=2v(AsO33-) b.溶液的pH不再变化
c.c(I-)=ymol·L-1 d.c(AsO43-)/c(AsO33-)不再变化
②tm时,v正____v逆(填“大于”、“小于”或“等于”)。
③) tm时v逆____tn时v逆(填“大于”、“小于”或“等于”),理由是___________。
④若平衡时溶液的pH=14,则该反应的平衡常数为_____(用x、y表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是

A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为: 2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol·L-1·s-1[
查看答案和解析>>
科目: 来源: 题型:
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

(1) “焙烧”时,提高反应速率的措施有____________(写一条)。
(2)炉气中的有害气体成分是__________。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(3)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(4)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(5)B、C最高价氧化物的晶体类型是分别是______晶体、______晶体
(6)画出D的核外电子排布图_____________,这样排布遵循了________原理和____________规则。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出NaHSO4在熔融状态下的电离方程式 _______。
(2)写出NaHCO3在水溶液中的电离方程式 ________。
(3)1mol乙烷气体(C2H6)在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3 kJ,写出乙烷燃烧热的热化学方程式________。
(4)含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7KJ的热量,表示该反应的热化学方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
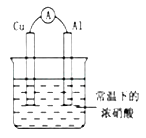
A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com