
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
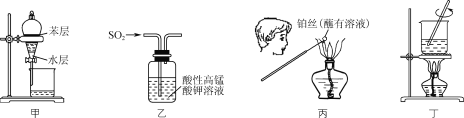
A.用装置甲从碘水中萃取碘B.用装置乙验证SO2的漂白性
C.用装置丙检验溶液中是否有K+D.用装置丁将FeCl3溶液蒸干制备FeCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
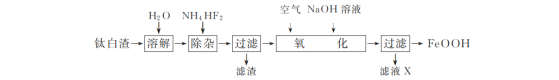
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
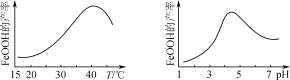
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下列说法正确的是
A.醋酸分子不可能存在于pH>7的碱性溶液中
B.NaCl溶液与CH3COONH4溶液均呈中性,所以等物质的量浓度的两种溶液中水的电离程度相等。
C.0.1mol·L-1硫化钠溶液中粒子浓度的关系:c(OH-)- c(H+)=c(HS-)+c(H2S)
D.同浓度的溶液:①(NH4)2SO4、②NH4HSO4、③NH4Cl中,c(NH4+)由大到小的顺序是①>②>③
查看答案和解析>>
科目: 来源: 题型:
【题目】用纳米Fe/Ni复合材料能去除污染水体的NO3,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3分两步,将步骤ii补充完整:

ⅰ.NO3+Fe+2H+=NO2+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3)为初始时NO3的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。

(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3,最终生成N2逸出。其装置及转化图如图所示:

①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(molL-1) | 2.0 | 1.0 | 0 |
平衡浓度/(molL-1) | c1 | c2 | 0.4 |
A.10min内,v(Cl2)=0.02mol/(Lmin)
B.升高温度,反应的平衡常数增大
C.反应达到平衡时容器内的压强与初始时容器的压强之比为1:2
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:

已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。

(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
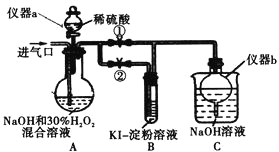
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
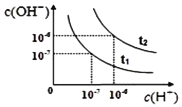
A.t1<t2
B.将t1温度下0.1 mol·L1的盐酸稀释,溶液中所有离子的浓度均相应减小
C.一定温度下,改变水溶液中c(H+)或 c(OH)的浓度,Kw不会发生变化
D.t2温度pH为2的HCl溶液中,水电离出的c(H+)=1×1010mol·L1
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)原子序数为33,可以形成As2S3、As2O5、H3ASO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在周期表中的位置为第___周期___族。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。若反应生成6mol单质硫,则需要___molO2。该反应需要在加压下进行,原因是___。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应2H3AsO4(s)=As2O5(s)+3H2O(l)的△H=___。
(4)298K时,将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是___(填标号)。
a.v(OH-)=2v(AsO33-)
b.I2的浓度不再变化
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③图中m点和n点的逆反应速率较大的是___。
④若平衡时溶液的c(H+)=10-14mol/L,则该反应的平衡常数K为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com