
科目: 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。

下列有关化合物X的说法正确的是
A. 分子中两个苯环一定处于同一平面
B. 不能与饱和Na2CO3溶液反应
C. 1 mol化合物X最多能与2 molNaOH反应
D. 在酸性条件下水解,水解产物只有一种
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
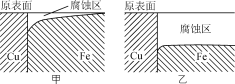
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e-=Fe3+
D.若在金属表面涂油漆,可以减弱铁的腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Na(s)![]() Na2O(s)
Na2O(s)![]() NaOH(aq)
NaOH(aq)
B.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq)![]() Al(s)
Al(s)
C.CaSO4(s)![]() CaCO3(s)
CaCO3(s)![]() Ca(NO3)2(aq)
Ca(NO3)2(aq)
D.Fe2O3(s)![]() Fe(s)
Fe(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl)>c(H+)>c(NH4+)>c(OH)
D.B与D等体积混合后,溶液中有c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2![]() 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
(2)提高2SO2(g)+O2(g)![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①温度为T℃时,在2 L的密闭容器中加入2.0 mol ![]() 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的![]() 。该反应的平衡常数为_____。
。该反应的平衡常数为_____。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气![]()
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______。
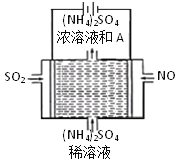
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }
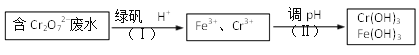
① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸与CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O
C.Cu与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH→CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com