
科目: 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-![]() H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
H+ + CO32-,下图为H2CO3、HCO3— 、CO32—在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。

(1)在pH=11时,H2CO3溶液中浓度最大的含碳元素的离子为__________。
(2)由图可知,碳酸的一级电离常数Ka1大约为______
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用下图装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
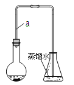
I.制备溴苯
(1)装置中长导管a的作用是______、导出气体,制备溴苯的反应方程式属于______反应,其方程式为________
(2)本实验所获得的溴苯为褐色,是因为________________。
II.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如下流程:
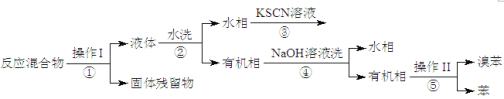
(3)操作Ⅱ为_____________。
(4)流程②和④中,需要用到的玻璃仪器是烧杯、_______;流程③的现象为______,流程④的作用是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
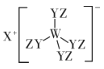
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定条件下某烃与H2按物质的量之比1:2如生成C2H5CH(CH3)2,则该烃的结构简式为(任写1种)_________
(2)分子式为C4H8的烃,核磁共振氢谱中含有两个吸收峰,峰面积之比为3:1,请写出符合条件的两种物质的结构简式________________、__________________
(3)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~己的物质。
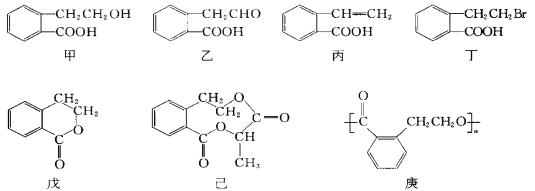
请回答下列问题:
①在甲~己六种物质中,互为同分异构体的是______(填编号,下同),可看作酯类的是________。
②写出由甲生成戊的方程式:_____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用系统命名法给下列有机物命名:
CH3CH2C(CH3)2CH2CH3_________________________________________
化合物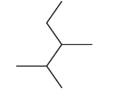 按系统命名法命名__________________________
按系统命名法命名__________________________
2,3-二甲基-4-乙基-2-庚烯的结构简式__________________________
(2)分子式为C4H8O2能发生水解反应的同分异构体有_____种,甲苯的一氯代物有______种。
(3)从某些植物树叶提取的挥发油中含有下列主要成分
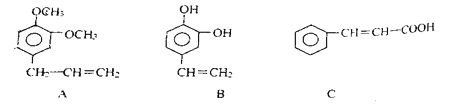
A的分子式是___________,B中的含氧官能团是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。

已知: PCl3熔点为-112℃,沸点为75.5℃。易被氧化,遇水易水解。与Cl2反应生成PCl5。
(1)A中反应的化学方程式为__________________。
(2)B中所装试剂名称是___________________,E中碱石灰的作用是___________________。
(3)实验时,检查装置气密性后,向C装置的曲颈甑中加入红磷,打开止水夹K通入干燥的CO2,一段时间后,关闭K,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是____________________。CO2______(选填“能”或“不能”)用Cl2代替,理由是________________。
(4)D中烧杯中盛装__________,其作用是_______________。
(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:浓度的大小顺序为①>②>③
B. HA的电离常数Ka =4.93×1010,则等浓度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A)
C. NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
D. 已知在相同条件下酸性HF >CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+) – c(F) >c(K+ ) c(CH3COO)
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点35℃,提取青蒿素的主要工艺为:

下列有关此工艺操作的说法不正确的是
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作II是蒸馏,利用了乙醚与青蒿素的沸点相差较大
D.操作II的主要过程为加水溶解,蒸发浓缩、冷却结晶、过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com