
科目: 来源: 题型:
【题目】生物基不饱和聚酯(UPOEM)具有出色的热稳定性、机械性和耐腐蚀性,广泛应用在包装、医用缝合线和药物封装等领域。其制备的核心反应如下:

下列说法正确的是
A.该反应为加聚反应
B.聚酯中不存在顺反异构
C.1mol III最多可与3mol H2反应
D.根据上述反应机理,可推知:
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验:
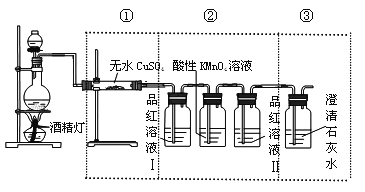
(1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________;
(2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”);
(3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1'NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法正确的是( )

A.OC段离子反应方程式为NH4++OH-=NH3·H2O
B.溶液中n(NH4+)=0.012mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是过滤、干燥、称量
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有0.1 mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是( )

A.NH4HCO3溶液中存在下列守恒关系:c(NH![]() )+c(NH3·H2O)=c(HCO
)+c(NH3·H2O)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH![]() 和HCO
和HCO![]() 浓度逐渐减小
浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO![]() )>c(NH
)>c(NH![]() )>c(NH3·H2O)>c(CO
)>c(NH3·H2O)>c(CO![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】向某密闭容器中充入1mol N2和3molH2,一定条件下发生反应N2(g) + 3H2(g) ![]() 2NH3(g),达到化学平衡时,下列说法正确的是( )
2NH3(g),达到化学平衡时,下列说法正确的是( )
A.反应停止了B.正逆反应速率相等
C.N2的浓度为0D.H2的转化率为100%
查看答案和解析>>
科目: 来源: 题型:
【题目】研究![]() 、
、![]() 、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:![]() 某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温
某研究小组向某密闭容器中加人一定量的活性炭和NO,恒温![]() 条件下反应,反应进行到不同时间测得各物质的浓度如下.
条件下反应,反应进行到不同时间测得各物质的浓度如下.
| NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
40 |
|
|
|
50 |
|
|
|
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______ ![]() 保留两位小数
保留两位小数![]() .
.
②![]() 后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ______ ;
③若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为5:3:3,则该反应的
的浓度之比为5:3:3,则该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(2)用![]() 催化还原氮氧化物可以消除氮氧化物的污染.已知:
催化还原氮氧化物可以消除氮氧化物的污染.已知:
①![]()
②![]()
③![]()
写出![]() 与
与![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 的热化学方程式 ______
的热化学方程式 ______
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的![]() ,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用
,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用![]() 外,还能得到一种复合肥料.
外,还能得到一种复合肥料.
①该复合肥料可能的化学式为 ______ ![]() 写出一种即可
写出一种即可![]() .
.
②若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈 ______ 性
恰好完全反应生成正盐,则此时溶液呈 ______ 性![]() 填“酸”或“碱”
填“酸”或“碱”![]() .
.![]() 已知常温下:氨水
已知常温下:氨水![]() ,
,![]()
![]() ,
,![]() .
.![]()
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图.催化剂b表面发生的电极反应式为 ______
的原理示意图.催化剂b表面发生的电极反应式为 ______ ![]() 常温下,
常温下,![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______ .
______ .

查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为Na1-mCoO2+NamCn![]() NaCoO2+Cn。下列说法正确的是( )
NaCoO2+Cn。下列说法正确的是( )
A.放电时,Na+向负极移动
B.放电时,正极的电极反应式为NamCn-me-=mNa++Cn
C.充电时,阴极质量减小.
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com