
科目: 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
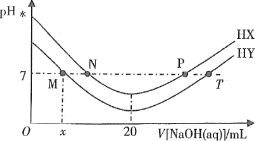
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业中的原料气制取与净化是重要的环节。
(1)已知有关反应的能量变化如图1:写出![]() 与
与![]() 反应制取
反应制取![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
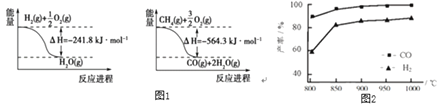
(2)“![]() 催化重整法”制氢气:
催化重整法”制氢气:![]() ,
,![]() 不仅可以得到合成气
不仅可以得到合成气![]() 和
和![]() ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的![]() ______
______![]() 。
。
化学键 | C-H | C=O | H-H |
|
键能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定体积比加入![]() 和
和![]() ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和![]() 产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
产率的影响如图2所示。实际生产中此反应优选温度为900℃,原因是______。
③某温度下,将![]() 、
、![]() 以及催化剂进行加入
以及催化剂进行加入![]() 容器中,达到平衡时
容器中,达到平衡时![]() ,平衡常数
,平衡常数![]() ______
______![]() 。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是:![]() ,必须除去原料气中CO的原因是______。醋酸二氨合铜
,必须除去原料气中CO的原因是______。醋酸二氨合铜![]() Ⅰ
Ⅰ![]() 吸收CO的生产适宜条件应是______
吸收CO的生产适宜条件应是______![]() 填序号
填序号![]() 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
查看答案和解析>>
科目: 来源: 题型:
【题目】电动汽车常用电池为钴酸锂电池,工作时原理如图,N极材料是金属锂和碳的复合材料,电解质为一种能传导Li+的固体电解质,电池反应式:
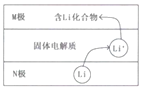
LixC6+Li1-xCoO2![]() C6+LiCoO2.下列说法错误的是( )
C6+LiCoO2.下列说法错误的是( )
A.放电时电子从N极流向M极
B.放电时N电极的反应式为:LixC6-xe-=xLi++C6
C.M极的物质具有较强还原性
D.相对于传统铅蓄电池,锂电池的比能量较高
查看答案和解析>>
科目: 来源: 题型:
【题目】全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
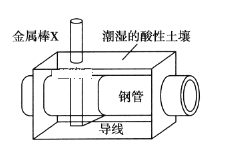
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
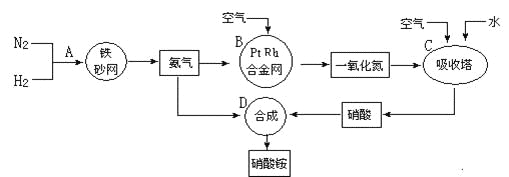
(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
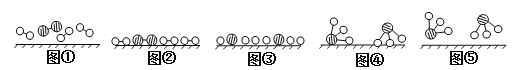
![]() 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2![]() 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:![]()
(1)写出该反应的逆反应的化学平衡常数表达式______,升高温度,该反应化学反应速率______,氢气的转化率______![]() 以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变”![]() 。实际生产中温度一般控制在
。实际生产中温度一般控制在![]() ,原因是______。
,原因是______。
(2)能表示该反应在恒温恒容密闭容器中![]() 时刻后已经达到平衡状态的图示是______。
时刻后已经达到平衡状态的图示是______。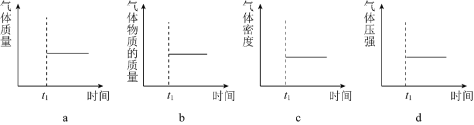
(3)浓度![]() 的氨水,pH为
的氨水,pH为![]() 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则![]() 的电离平衡将向______方向移动
的电离平衡将向______方向移动![]() 填“正”或“逆”
填“正”或“逆”![]() ,溶液的pH将为______
,溶液的pH将为______![]() “大于”“小于”“等于”
“大于”“小于”“等于”![]() 。
。
设计一个简单实验,证明一水合氨是弱碱:______。
某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)
![]()
浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(4)氯化铵饱和溶液中离子浓度由大到小的顺序是______。白烟的成分是______。
(5)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因![]() 写出一条即可
写出一条即可![]() ______
______
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaC1O2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程,下列说法错误的是( )
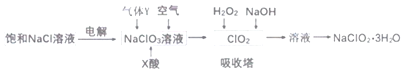
A.本工艺电解饱和氯化钠溶液时,阳极主要产生氯气,阴极产生氢气
B.吸收塔内的温度不宜过高
C.气体Y具有还原性
D.吸收塔中发生的离子反应为:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g)N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
A | B | C | D |
|
|
|
|
t1时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数减小 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康。海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
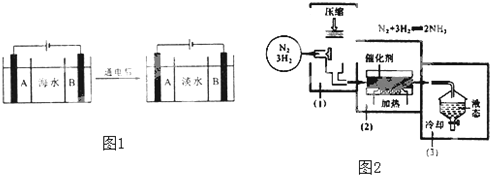
(1)天然水净化处理过程中需要加入混凝剂,常用的混凝剂有明矾、硫酸铝、硫酸铁等,其净水作用的原理是 ______。
(2)水的净化与软化的区别是:水的净化是指 ______ ,而水的软化是指 ______。
(3)目前,国际上实用的“海水淡化”主要技术之一是电渗析法,图是利用电渗析法对海水进行淡化处理的原理图。已知海水中含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子,电极为惰性电极。
等离子,电极为惰性电极。
①阳离子交换膜![]() 只允许阳离子通过
只允许阳离子通过![]() 是 ______
是 ______ ![]() 填“A”或“B”
填“A”或“B”![]() 。
。
②写出通电后阳极区的电极反应式 ______ 。
(4)海水除了可以得到淡化水之外,还可提取多种化工原料.由海水制备无水氯化镁主要有以下步骤:在一定条件下脱水干燥;加熟石灰;加盐酸;过滤;浓缩结晶。其先后顺序正确的是 ______ ![]() 填序号
填序号![]() 。
。
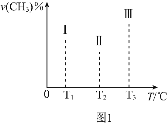
(5)海水电解制得的氢气用于合成氨,某合成氨厂生产流程图如图:
①第(1)个设备中先把![]() 和
和![]() 压缩的目的是 ______ 。
压缩的目的是 ______ 。
②在第(3)个设备中用冷却方法分离出 ______ ,其目的是 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
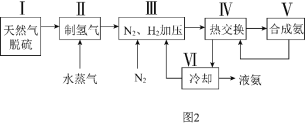
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
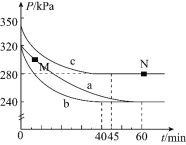
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com