
科目: 来源: 题型:
【题目】以软锰矿粉末(主要成分MnO2,还含有Al2O3、Fe2O3等杂质)为原料制MnSO4·H2O的工艺流程如下:
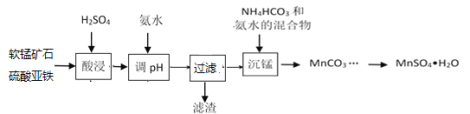
已知:pH>3.3后溶液不存在Fe3+,pH>5.0后溶液不存在Al3+,pH>8后Mn2+开始沉淀。
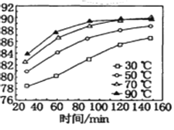
(1)保持其他条件不变,在不同温度下对含软锰矿粉进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
(2)“酸浸”时,会将Fe2+氧化至Fe3+,所发生的反应离子方程式为__________。
(3)酸浸时要加入硫酸,硫酸浓度不能过大或者过小。当硫酸浓度过小时,酸浸会有红褐色残渣出现,原因是_____________________________。
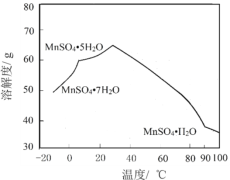
(4)MnSO4在水中的溶解度与温度关系如图。由MnCO3获得较纯净的MnSO4H2O晶体的方法是:将MnCO3溶于_________,控制温度为_________以上结晶,得到MnSO4H2O晶体,洗涤、烘干。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )

A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤脱硫的反应为2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H<0。500℃时,实验测得在2L刚性密闭容器中该反应在不同时刻O2、CO2的物质的量(或物质的量浓度)如下表所示,下列判断正确的是( )
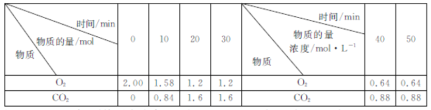
A.0~10min内,平均反应速率v(SO2)=0.084mol·L-1·min-1
B.30min后,改变的条件只能是增大O2的通入量
C.若容器绝热,则20min时,![]() >
>![]()
D.化学平衡常数:30min<40min
查看答案和解析>>
科目: 来源: 题型:
【题目】铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )
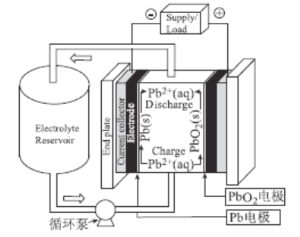
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJmol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJmol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJmol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s)![]() Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 molL-1氯化铝溶液中,银离子浓度最大可达到_____________molL-1。
(3)20 ℃时,0.1 molL-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________molL-1(填数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸( )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
![]()
 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:

请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。
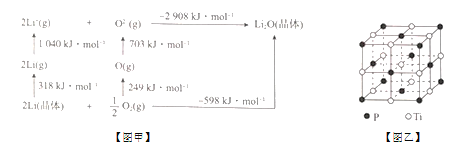
(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷石膏是硫酸分解磷矿制取磷酸过程中的副产物,其主要组分为CaSO4,氢气还原分解硫酸钙的部分反应如下:
①2CaSO4(s)=2CaO(s)+2SO2(g)+O2(g) ΔH1=akJ·mol-1
②CaSO4(s)+H2(g)=CaO(s)+H2O(l)+SO2(g) ΔH2=bkJ·mol-1
③CaSO4(s)+4H2(g)=CaS(s)+4H2O(l) ΔH3=ckJ·mol-1
④3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) ΔH4=dkJ·mol-1
下列说法正确的是( )
A.反应①中a<0
B.反应③在常温下能自发进行,说明c>0
C.c=4b-d
D.反应H2(g)+![]() O2(g)=H2O(l)的△H=(2b-a)kJmol-1
O2(g)=H2O(l)的△H=(2b-a)kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将4.0 mol SO2与2.0 mol O2的混合气体充入容积为2.0 L的密闭容器中发生反应:2SO2 + O2![]() 2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
2SO3,经过2.0 min达到平衡状态,SO2的平衡转化率为90.0%。
(1)0~2 min内O2的平均反应速率v(O2)=_______________。
(2)该温度下此反应的化学平衡常数K=________________。
(3)在相同的温度下,某容器内c(SO2)=c(O2)=c(SO3)=1.0 molL-1,则此时反应速率v正________v逆(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com