
科目: 来源: 题型:
【题目】如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) N2O4(无色)]
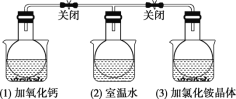
下列叙述正确的是( )
A.2NO2N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是___(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则该温度下上述反应的平衡常数K=___(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。升高温度____;
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
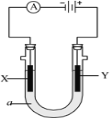
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是___。在X极附近观察到的现象是___。
②Y电极上的电极反应式是___,检验该电极反应产物的方法是___。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的电极反应式是___。
②Y电极的材料是___。
③假若电路中有0.04摩尔电子通过时,阴极增重___克。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察:
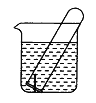
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生___腐蚀,正极反应式:___。
(3)若试管内液面下降,正极反应式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 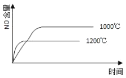
B. 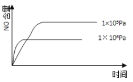
C. 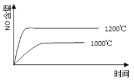
D. 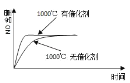
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为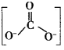 )
)
③NaNT可以![]() (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol![]() 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
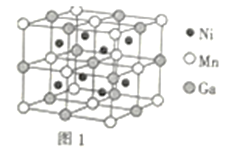
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
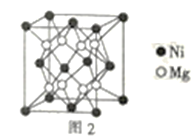
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)gcm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性,都有着广泛的用途。
(1)已知:①N2H4(1)+O2(g)=N2(g)+2H2O(g) △H1=-621.5kJmol-1
②N2O4(1)=N2(g)+2O2(g) △H2=+204.3kJmol-1
则火箭燃料的燃烧反应为2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H=__。
(2)已知反应N2H4(g)+2Cl2(g)![]() N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T℃时,向2L恒容密闭容器中加入2molN2H4(g)和4molCl2(g),测得Cl2和HCl的浓度随时间的关系如图所示。

①0~10min内,用N2(g)表示的平均反应速率v(N2)=__。
②M点时,N2H4的转化率为__(精确到0.1)%。
③T℃时,达到平衡后再向该容器中加入1.2molN2H4(g)、0.4molCl2(g)、0.8molN2(g)、1.2molHCl(g),此时平衡__(填“正向移动”“逆向移动”或“不移动”)。
(3)①次磷酸(H3PO2)是一元酸,常温下,1.0molL-1的NaH2PO2溶液pH为8,则次磷酸的Ka=__。
②用次磷酸钠通过电渗析法制备次磷酸,装置如图所示。交换膜A属于__(“阳离子”或“阴离子”)交换膜,电极N的电极反应式为___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com