
科目: 来源: 题型:
【题目】氟硼酸亚锡[Sn(BF4)2]用于粮食制品中防止有机酸的腐蚀。受热或遇水易分解或水解,长期放置在空气中易氧化。以氟硅酸(H2SiF6,二元强酸,易溶于水,其钠盐溶解度较小、硼酸[H3BO3],一元弱酸,酸根为![]() 等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。
等为原料制备氟硼酸亚锡,同时得白炭黑(SiO2)和Na2SiF6等副产物的工艺流程如图所示。

(1)硼酸在水溶液中的电离方程式_____。硼酸水溶液中水的电离程度_____(填“大于”或“小于”或“等于”)同温度下纯水的电离程度。
(2)流程中过程③由锡石制备锡一般工业上加入焦炭,该方法冶炼锡属于哪种冶金方法_____。
A.热分解法 B.电解法 C.热还原法
(3)写出反应④发生的主要反应的化学方程式_____。
(4)原料经反应①过滤后得残留氟硅酸(H2SiF6)杂质的氟硼酸(HBF4)溶液,写出反应①的化学方程式_____。
(5)离心分离前步骤②加NaCl的目的是_____。
(6)氟硼酸亚锡[Sn(BF4)2]的正确保存方法_____。
查看答案和解析>>
科目: 来源: 题型:
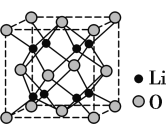
【题目】(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为__________ g·cm-3(列出计算式)。
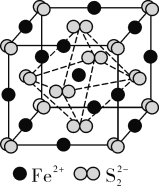
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S![]() 所形成的正八面体的体心,该正八面体的边长为____nm。
所形成的正八面体的体心,该正八面体的边长为____nm。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
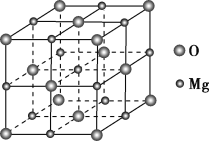
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为____________nm。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NixO晶体晶胞结构为NaCl型(如图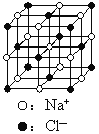 ),由于晶体缺陷,x值于小于1。测知NixO晶体密度ρ为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283=78.4 ,
),由于晶体缺陷,x值于小于1。测知NixO晶体密度ρ为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283=78.4 ,![]() =1.414)
=1.414)
(1)晶胞中两个Ni离子之间的最短距离___________(精确至0.01)。
(2)与O2-距离最近且等距离的Ni离子围成的几何体形状_______。
(3)求NixO中x值为_________(精确至0.01)。
(4)晶体中的Ni分别为Ni2﹢、Ni3﹢,求此晶体的化学式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
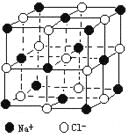
查看答案和解析>>
科目: 来源: 题型:
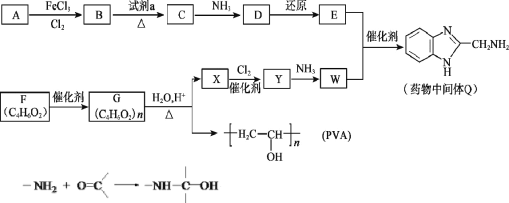
【题目】药物中间体Q、医用材料PVA的合成路线如下。
已知:
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)F含有的官能团是________。
(5)F的含有碳碳双键和酯基的同分异构体有_____种(含顺反异构体,不含F),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是___.
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
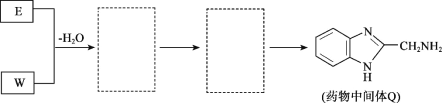
(8)将下列E+W→Q的流程图补充完整(在虚线框内写出物质的结构简式):_________
查看答案和解析>>
科目: 来源: 题型:
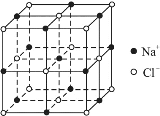
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
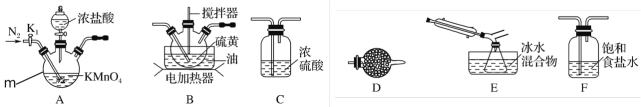
①仪器m的名称为___________,装置F中试剂的作用是__________。
②装置连接顺序:A→_______________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和_____________。
(2)S2Cl2遇水强烈反应产生烟雾,该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案_________(填“可行”或“不可行”),原因是___________。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是____________(填标号)。
aH2O2溶液 bKMnO4溶液(硫酸酸化) c氯水
②该混合气体中气体X的体积分数为_____________(用含V、m的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物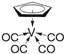 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
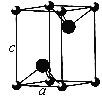
①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
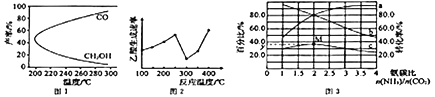
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
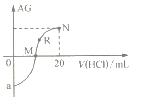
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com