
科目: 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
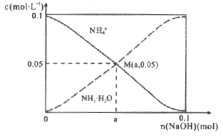
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池又称为“摇摆电池”,广泛使用于电动自行车等,其充放电过程就是锂离子的嵌入和脱嵌过程(习惯上正极用嵌入或脱嵌表示,负极用插入或脱插表示),即充放电过程就是锂离子在正、负极间往返运动而形成电流。其装置结构简图如图所示(电解液为溶有LiPF6的碳酸酯类溶剂,隔膜为仅有锂离子能通过的高分子膜),工作原理为C6Li+Li(1-x)MO2![]() LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
LiMO2+C6Li(1-x)(M代表过渡元素),则下列说法错误的是( )
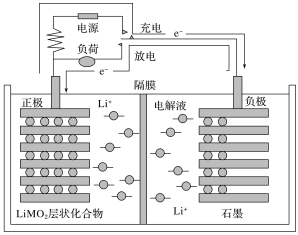
A.电池放电时,正极为石墨
B.锂离子电池的优点是质量小,电容量大,可重复多次使用
C.电池充电时阳极的反应为LiMO2-xe-=Li(1-x)MO2+xLi+
D.锂离子电池的电解液不能是水溶液,因为锂是活泼金属,能与水反应
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数依次增大,W的某种原子无中子,X、Y可形成原子个数比为1∶1的具有漂白性的物质,工业上常用电解饱和YZ溶液来获得Z的单质及其他产品。下列说法正确的是
A. W和X、Y、Z均能形成18电子的分子
B. 上述四种元素的原子半径大小顺序为r(Z)>r(Y)>r(X)>r(W)
C. X、Y之间形成的化合物可能同时含有离子键和非极性共价健
D. W、X、Z三种元素形成的化合物一定是弱酸
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.7.8 g 的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3NA
B.常温常压下,22.4 LCO2 中含有NA个CO2 分子
C.1.0 L 1.0mol·L-1的 NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g 羟基(-17OH)中所含的中子数为8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。他们在一定条件下可发生转化,如图所示,有关说法正确的是
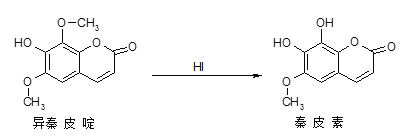
A.异秦皮啶与秦皮素互为同系物
B.1mol秦皮素最多可与4mol NaOH反应
C.鉴别异秦皮啶与秦皮素可用FeCl3溶液
D.上述反应为还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】中学常见反应的化学方程式是![]() (未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是____,该反应的离子方程式是___________。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是_____。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是_________。
②含![]() 的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__
的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是__![]() 。
。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的![]() 溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1∶4恰好反应,则反应的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O是优良的催化剂和半导体材料,工业上常用下列方法制备Cu2O。
(1)热还原法
加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu2O,同时放出N2。该反应的化学方程式为________________。
(2)电解法 以氢氧燃料电池为电源,用电解法制备Cu2O的装置如图。
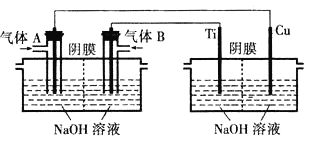
①A的化学式为________________。
②燃料电池中,OH-的移动方向为________________(填“由左向右”或“由右向左”);电解池中,阳极的电极反应式为________________。
③电解一段时间后,欲使阴极室溶液恢复原来组成,应向其中补充一定量________________(填化学式)。
④制备过程中,可循环利用的物质为________________(填化学式)。
(3)干法还原法
利用反应Cu +CuO![]() Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为________。
Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
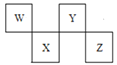
【题目】W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。
请回答下列问题。
(1)H2Y2的电子式为___________,Z在周期表中的位置___________。
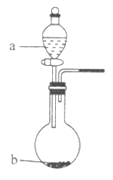
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
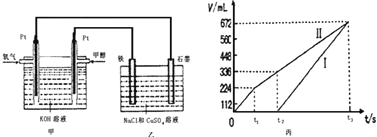
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
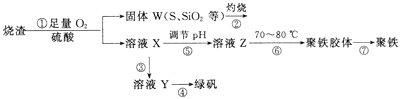
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。
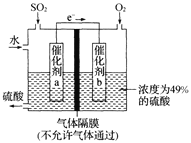
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com