
科目: 来源: 题型:
【题目】肉桂酸(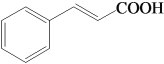 )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为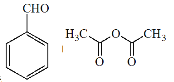
![]()
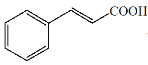 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:
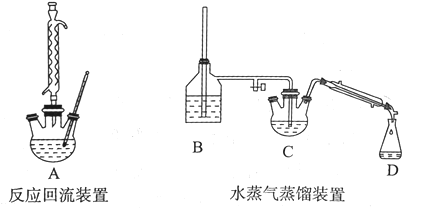
请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。

(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某班学生通过分组实验测定酸碱滴定曲线。
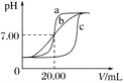
实验用品:0.1 mol·L-1HCl溶液、0.1 mol·L-1NaOH溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶。甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00 mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,其中乙和丙两组同学的操作上都存在着不足或失误。
请回答下列问题:
(1)实验前pH计应用标准溶液进行校准,若将pH计放入c(H+)=0.0001 mol·L-1的标准溶液中校准,则pH计的读数应为________。
(2)甲组同学滴定时选用的滴定管为________(填“酸式”或“碱式”)滴定管,最后一次润洗滴定管应选用实验用品中的________进行润洗。
(3)乙组同学操作上的不足之处是________________________________________。
(4)造成丙组同学的曲线与甲组同学不同的原因可能是________(填字母)。
A.用待装液润洗锥形瓶
B.滴定使用的滴定管的尖嘴部分在滴定前有气泡未排出,滴定后气泡消失
C.滴定前后对滴定管进行读数的视线分别如图所示

查看答案和解析>>
科目: 来源: 题型:
【题目】CO、H2是煤的气化产物,在生产生活中用途广泛。
(1)CO还原法处理大气污染物SO2
①2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
S(s)+2CO2(g) H = -270 kJ·mol-1,该反应的平衡常数表达式为__。
②在绝热恒容的密闭容器中进行上述反应,下列说法正确的是_____。
a 若混合气体密度保持不变,则已达平衡状态
b 达平衡后若再充人一定量CO2,平衡常数保持不变
c 分离出部分S,正、逆反应速率均保持不变,平衡不移动
d 从反应开始到平衡,容器内气体的压强保持不变
③向2 L恒温恒容密闭容器中通人2 mol CO、1 mol SO2,分别进行a、b、c三组实验。在不同催化剂件下发生反应:2CO(g) + SO2(g) ![]() S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
S(s)+2CO2(g) H = -270 kJ·mol-1,反应体系总压随时间的变化如下表所示,则三组实验温度的大小关系是_____(用a、b、c表示),实验a从反应开始至45s达到平衡,则该过程反应速率v(SO2)__________(结果保留2位有效数字)。
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
(2)利用CO、H2可制备天然气,主要反应为:
CO(g) + 3H2(g) ![]() CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CH4(g) + H2O(g) H1=-206.2 kJ·mol-1;
CO(g) + H2O(g) ![]() CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
CO2(g) + H2(g) H2 = -41.0 kJ·mol-1;
H2O(l) ═H2O(g) H3 =+44 kJ·mol-1 。
回答下列问题:
①反应CO2(g) + 4H2(g) ![]() CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
CH4(g) + 2H2O(l) 的H4 = ________ kJ·mol-1。某温度下,分别在起始容积相同的恒压容器A、恒容容器B中加人1molCO2和4molH2的混合气体,两容器反应达到平衡后放出或吸收的热量较多的是__( 填“A”或“B")。
②在恒压管道反应器中按n(H2):n(CO) = 3:1通入原料气,在催化剂作用下制备合成天然气,400 ℃ p总为100 kPa时反应体系平衡组成如下表所示:
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
则该条件下CO的总转化率α=____。![]()
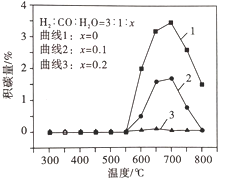
③制备合成天然气采用在原料气中通入水蒸气来缓解催化剂积碳。
积碳反应为:反应I :CH4(g) ![]() C(s) + 2H2(g) H = +75 kJ·mol-1;
C(s) + 2H2(g) H = +75 kJ·mol-1;
反应Ⅱ:2CO(g) ![]() C(s) + CO2(g) H = -172 kJ·mol-1,
C(s) + CO2(g) H = -172 kJ·mol-1,
平衡体系中水蒸气浓度对积碳量的影响如图所示,下列说法正确的是__。
A 曲线1在700 ~ 800℃积碳量减小的原因可能是反应Ⅱ逆向移动
B 曲线1在550 ~700℃积碳量增大的原因可能是反应I、Ⅱ的速率增大
C 曲线2、3在550 ~800℃积碳量较低的原因是水蒸气稀释作用使积碳反应速率减小
D 水蒸气能吸收反应放出的热量,降低体系温度至550℃以下,有利于减少积碳
查看答案和解析>>
科目: 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
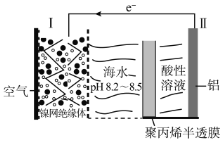
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
查看答案和解析>>
科目: 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
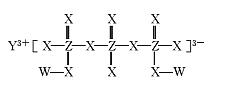
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】β一l,3一葡聚糖具有明显的抗肿瘤功效,受到日益广泛的关注。β-l,3一葡聚糖的结构简式如图,下列说法正确的是

A.分子式为(C6Hl2O6)nB.与葡萄糖互为同系物
C.可以发生氧化反应D.葡萄糖发生加聚反应可生成β-l,3一葡聚糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com