
科目: 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )

A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
查看答案和解析>>
科目: 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:
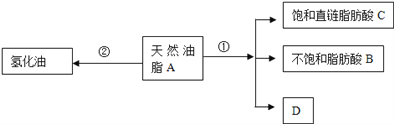
已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 甲烷与 | 产物能使湿润的蓝色石蕊试纸变红 | 氯代烷在水中电离出 |
B | 向填有硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
C | 向 | 产生黑色沉淀 | 硫酸的酸性弱于 |
D | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 产生大量白烟,瓶内有黑色颗粒产生 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物![]() 是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
是桥环烯烃类化合物,在药物合成、材料化学以及生命科学中有着重要的应用。下列关于该化合物的叙述正确的是( )
A.分子式为C11H10
B.—氯代物有5种(不考虑立体异构)
C.不能形成高分子化合物
D.1mol该化合物最多能与3molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA
B.常温常压下,3.4g羟基(-OH)所含的电子数目为1.8NA
C.等物质的量的A1分别与足量盐酸和NaOH溶液反应,转移的电子数均为3NA
D.25℃时,1LpH=8的CH3COONa溶液中,水电离出的OH-数目为10-8NA
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
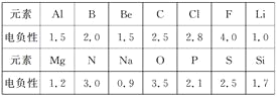
①判断下列化合物中属于离子化合物的是________(填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________;NCl3水解产物为____________________。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
![]()
①铍的最高价氧化物的水化物是________(填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________(用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
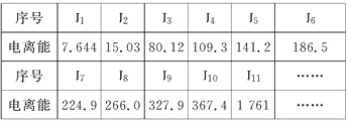
①外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________(填“大”或“小”);
②上述11个电子分属________个电子层;
③失去了11个电子后,该元素还有________个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
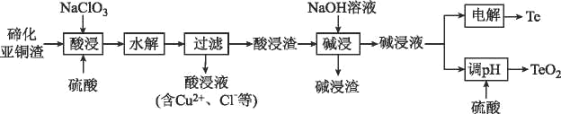
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用亚硝酸钠![]() 作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备
作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备![]() 并探究NO、
并探究NO、![]() 的某一化学性质
的某一化学性质![]() 中加热装置已略去
中加热装置已略去![]() 。请回答下列问题:
。请回答下列问题:
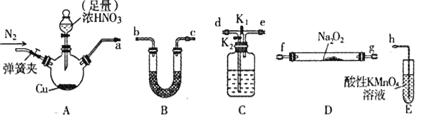
已知:①2NO+Na2O2=2NaNO2
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
(1)装置A三颈烧瓶中发生反应的化学方程式为____________。
(2)用上图中的装置制备![]() ,其连接顺序为:
,其连接顺序为:![]() ___
___![]() ____
____![]() ___
___![]() ___
___![]() ___
___![]() ___
___![]() 按气流方向,用小写字母表示
按气流方向,用小写字母表示![]() ,此时活塞
,此时活塞![]() 、
、![]() 如何操作____________。
如何操作____________。
(3)![]() 装置发生反应的离子方程式是________________。
装置发生反应的离子方程式是________________。
(4)通过查阅资料,![]() 或NO可能与溶液中
或NO可能与溶液中![]() 发生反应。某同学选择上述装置并按
发生反应。某同学选择上述装置并按![]() 顺序连接,E中装入
顺序连接,E中装入![]() 溶液,进行如下实验探究。
溶液,进行如下实验探究。
步骤 | 操作及现象 |
① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色。 |
② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间 |
③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同 |
步骤②操作的目的是___________;步骤③C瓶中发生的化学方程式为_________________;通过实验可以得出:___________![]() 填“
填“![]() 、NO中的一种或两种”
、NO中的一种或两种”![]() 和溶液中
和溶液中![]() 发生反应使溶液呈深棕色。
发生反应使溶液呈深棕色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com